由铝屑、盐酸、氢氧化钠溶液反应制取1mol Al(OH)3,至少需要消耗HCl和NaOH的物质的量为
| A.0.25mol,0.25mol | B.0.75mol,0.75mol |
| C.1mol,1mol | D.3mol,3mol |
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。
下列说法正确的是()
| A.X和R在同一周期 |
| B.原子半径:W>R>X |
| C.气态氢化物的稳定性:Y>X |
| D.X、Z形成的化合物中可能含有共价键 |
“天宫一号”飞行器白天靠太阳能帆板产生电流向镍氢电池充电,夜间镍氢电池向飞行器供电。镍氢电池结构示意图如图。若电池总反应为:Ni(OH)2 NiO(OH)+1/2H2,充电时阴极反应为:H2O+e-=1/2H2+OH-。则下列说法正确的是()
NiO(OH)+1/2H2,充电时阴极反应为:H2O+e-=1/2H2+OH-。则下列说法正确的是()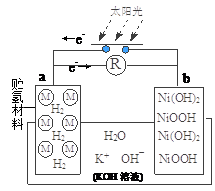
| A.充电时a极为正极 |
| B.放电时NiO(OH)发生氧化反应 |
| C.充电时,K+移向a极,OH-移向b极 |
| D.放电时正极反应为:NiO(OH) + H2O +e- = Ni(OH)2 + OH- |
用下列实验装置进行相应的实验,能达到实验目的的是()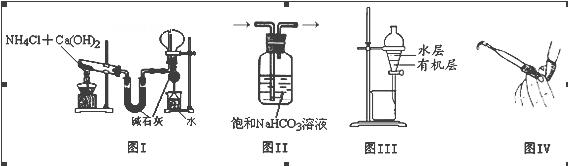
| A.图I用于实验室制氨气并收集干燥的氨气 |
| B.图II用于除去CO2中含有的少量HCl |
| C.图III用于提取I2的CCl4溶液中的I2 |
| D.图IV用于检查碱式滴定管是否漏液 |
下列有关海水综合利用的说法正确的是()
| A.海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| B.电解MgCl2饱和溶液,可制得金属镁 |
| C.从海水中可以得到NaCl,电解熔融NaCl可制得金属钠 |
| D.从海带中提取碘单质的过程不涉及氧化还原反应 |
CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是 ()
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是 ()
| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |