(14分)欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:

方法二:
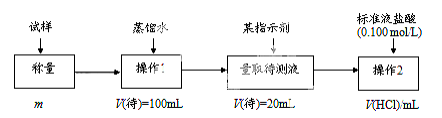
方法三:
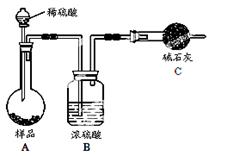
方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
(1)方法一:加入足量的试剂A (填写A的化学式)可将HCO3-离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、 、洗涤和烘干;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要的用到的是 ,在操作2中应选择的指示剂是 ;
(3)在方法二中计算该样品中NaHCO3的质量分数为 [用流程图中的数据m、V(HCl) 填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是 ;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是 ,偏低的原因可能是(均文字简述) ;
(6)方法四的实验原理是: (用化学方程式表示)。
(届河北省唐山市高三第一次模拟考试理综化学试卷)
氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。
(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 |
实验药品 |
制备原理 |
|
| 甲小组 |
A |
氢氧化钙、氯化铵 |
反应的化学方程式为 ① |
| 乙小组 |
② |
浓氨水、氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用: ③ |
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____,硬质玻璃管中氨发生催化氧化反应的化学方程式为。
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有。
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由。
(届四川省泸州市高三第一次诊断性考试化学试卷)
在高温时硫铁矿(主要成分FeS2)和氧气反应生成三氧化二铁和二氧化硫(假设硫铁矿中的杂质不参与化学反应)。某化学研究学习小组对硫铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
I.实验装置如下图所示(夹持和加热装置已省略)。A中的试剂是双氧水,将m·g该硫铁矿样品放人硬质玻璃管D中。从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管D中的硫铁矿样品至反应完全。
II.反应结束后,将E瓶中的溶液进行如下处理:
【实验二】测定铁元素的含量
III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解已冷却的硬质玻璃管D中的固体,过滤,得到滤液A;
②在滤液A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
③将滤液B稀释为250 mL;
④取稀释液25.00 mL,用浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体
积的平均值为V mL。
请根据以上实验,回答下列问题:
(1)I中装置C中盛装的试剂是_;E瓶的作用是_。
(2)11中加入过量H2O2溶液发生反应的离子方程式为____。
(3)111的步骤③中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,
还必须要用到的是_;④中盛装KMnO3溶液的仪器是_。
(4)假设在整个实验过程中硫元素和铁元素都没有损失,则该硫铁矿样品中硫元素的质量分数为_。(用含m1和m2的代数式表示);铁元素的质量分数为____。(用含m1、c、v的代数式表示)
(届河南省中原名校高三下学期第一次联考化学试卷)
亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及生成气体产物的成分。已知:
①NO+NO2+2OH-=2NO2-+2H2O
②气体液化的温度:NO2 21℃、NO-152℃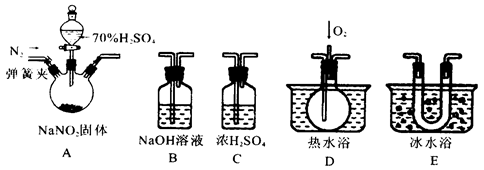
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→C→_______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体.
①确认A中产生气体含有NO,依据的现象是_____________________________.
②装置E的作用是_______________________________________________________
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________________.
如果没有装置C,对实验结论造成的影响是______________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则CH4将NO2还原为NO的热化学方程式为:___________________________.
(届浙江省温州市十校联合体高三上学期期中联考化学试卷)
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L–1的Cu(NO3)2溶液、2.0mL 0.50 mol·L–1的NaOH溶液和0.25 mol·L–1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
表Ⅰ表Ⅱ
| 编号 |
V (Na2CO3)/mL |
沉淀情况 |
编号 |
反应温度/℃ |
沉淀情况 |
|
| 1 |
2.8 |
多、蓝色 |
1 |
40 |
多、蓝色 |
|
| 2 |
2.4 |
多、蓝色 |
2 |
60 |
少、浅绿色 |
|
| 3 |
2.0 |
较多、绿色 |
3 |
75 |
较多、绿色 |
|
| 4 |
1.6 |
较少、绿色 |
4 |
80 |
较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的最佳条件是。
②80℃时,所制得的孔雀石有少量褐色物质的可能原因是。
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验: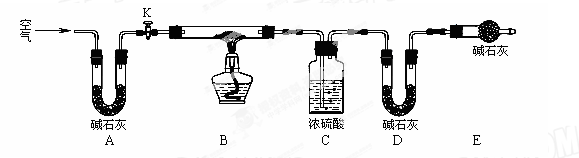
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:(请补充该步操作内容)。
步骤5:称量相关装置的质量。
①装置A的作用是;若无装置E,则实验测定的x/y的值将。(选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的(写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式。
(届四川省眉山市高三第一次诊断性考试化学试卷)
根据Mg能在CO2中燃烧,某兴趣小组推测Na应该也能在CO2中燃烧,且固体产物可能为C、Na2O和Na2CO3中的两种或三种。该小组用如下图装置进行了实验探究。已知PdCl2能被CO还原得到黑色的Pd。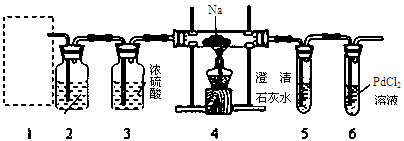
回答下列问题:
(1)为了使反应随开随用,随关随停,上图虚线方框内应选用装置(填下图字母代号),如何检验所选装置的气密性。
(2)装置2中所盛试剂为。
A.NaOH溶液B.饱和NaHCO3溶液
C.饱和Na2CO3溶液D.饱和NaCl溶液
(3)检测装置的气密性完好并装好药品后,在点燃酒精灯前应先进行装置1中的反应操作,待观察到现象时,再点燃酒精灯,这步操作的目的是。
(4)由实验现象和进一步的探究得出反应机理。
A.装置6中有黑色沉淀生成;
B.取反应后直玻管中的固体物质23.0g溶于足量的水中,无气泡产生且得到澄清的溶液;将溶液加水稀释配成250 mL的溶液;
C.取25.00ml步骤B的溶液,滴加足量BaCl2溶液,将生成的白色沉淀过滤、洗涤、干燥,称量得固体质量为1.97g。
①步骤C中不溶物干燥前必须经过洗涤,如何检验该沉淀是否洗涤干净。
②该探究得出钠与二氧化碳反应的化学方程式为。