有M、N两溶液,各含有下列十四种离子中的七种离子:Al3+、Na+、K+、Fe3+、NH4+、H+、NO3-、OH-、MnO4-、Cl-、SO32-、SO42-、CO32-、AlO2-。已知两溶液所含离子各不相同,每组溶液中的阳离子至少有2种,则下列说法正确的是
| A.如果M溶液呈强酸性,则N溶液中可能含有的阴离子有:OH-、NO3-、CO32- |
| B.如果M溶液呈强碱性,则N溶液中可能含有的阴离子有:MnO4-、AlO2-、SO42- |
| C.如果M溶液具有强还原性,则N溶液中可能含有的阴离子有:MnO4-、NO3-、SO42- |
| D.如果M溶液具有强氧化性,则N溶液中可能含有的阳离子有:K+、Na+、 NH4+ |
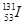 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中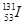 的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
的含量变化来检测核电站是否发生放射性物质泄漏。下列有关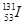 的叙述中错误的是( )
的叙述中错误的是( )
A.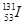 的化学性质与 的化学性质与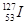 相同 相同 |
B.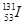 的原子序数为53 的原子序数为53 |
C.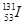 的原子核外电子数为78 的原子核外电子数为78 |
D.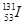 的原子核内中子数多于质子数 的原子核内中子数多于质子数 |
CH3COOH分别与CH3CH2OH和CH3CH218OH反应,生成的酯的相对分子质量关系( )
| A.前者大于后者 | B.前者小于后者 |
| C.前者等于后者 | D.无法判断 |
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q |
| D.最高价氧化物的水化物的酸性:T>Q |
下列离子方程式书写正确的是( )
| A.少量CO2通入Ba(OH)2溶液中:CO2+2OH—= CO32— +H2O |
| B.NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42—恰好沉淀完全 NH4++Al3++2SO42—+2Ba2++4OH—= NH3·H2O+Al(OH)3↓+2BaSO4↓ |
| C.FeCl3溶液腐蚀铜线路板:Fe3++Cu = Fe2++Cu2+ |
| D.向NaHCO3溶液中滴入少量Ca(OH)2溶液:HCO3—+OH—= CO32—+H2O |
下列叙述中错误的是 ()
| A.原子半径:Cl>S>O | B.还原性:Na>Mg>Al |
| C.稳定性:HF>HCl>HBr | D.酸性:HClO4>H2SO4>H3PO4 |