某废水中可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2一、CO32-、S2一、SO32-、SO42-
现取该溶液进行有关实验,实验过程及现象如下: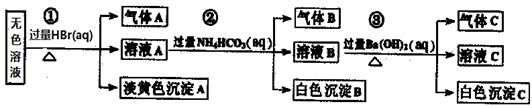
下列说法正确的是
| A.根据实验①中的现象可推出,气体A一定是纯净物,淡黄色沉淀一定是AgBr |
| B.根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有Al3+ |
| C.根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4 |
| D.原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42- |
下列化学用语或模型正确的是
A.氯化氢的电子式: |
B.8个中子的碳原子:12C |
C.硫离子结构示意图: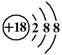 |
D.CH4分子的比例模型: |
下列关于化学反应和能量变化关系的描述中,说法不正确的是
| A.放热反应,不必加热就一定能发生 |
| B.化学反应中一定有能量变化 |
| C.吸热反应不一定需要加热也能发生 |
| D.热化学方程式中,热效应数值与反应物的物质的量多少有关 |
人类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能的转换形态),届时人们将适应“低碳经济”和“低碳生活”。下列说法不正确的是
| A.煤、石油和天然气都属于碳素燃料 |
| B.发展太阳能经济有助于减缓温室效应 |
| C.太阳能电池可将太阳能转化为电能 |
| D.目前研究菠菜蛋白质“发电”不属于“太阳能文明” |
某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为()
A.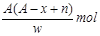 |
B.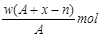 |
C.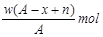 |
D. |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s) 则下列说法错误的是
| A.电池工作时,锌失去电子,电极反应式为:Zn +2OH-—2e- = Zn(OH)2(s) |
| B.电池正极的电极反应式为:2MnO2(s) + H2O(l) +2e-=Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |