化合物A是尿路结石的主要成分,属于结晶水合物,可用X·nH2O表示。在一定条件下有如下图所示的转化关系:

已知:
①经分析,上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是1∶1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
② G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的一个主要原因。
③反应②、③是重要的化工反应,I是一种重要的化工原料。
④上图中的部分变化经定量测定,得到如右图所示的固体产物的质量m随温度[t (℃)]的变化曲线。回答下列问题:
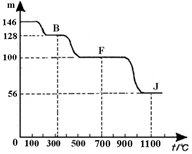
(1)写出A的化学式: ,D中阴离子的结构示意图为 ;
(2)反应①的化学方程式为: 。
(3)K与G在一定条件下可生成多种物质,既可获得经济效益,也减少对环境的污染。
① 若O是一种易挥发的液态燃料,有毒,误饮5-10mL会导致双目失明。则O的分子式为: 。
② 若O是K与G按1∶3的比例反应而得,则O可能是 。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
已知:氯代烃可以与苯在催化剂剂下反应生成氯代苯和氯化氢;苯与浓硫酸作用可以生成苯磺酸。现以十二烷和苯为原料生产对十二烷基苯磺酸钠。写出反应的化学方程式(其它无机原料自选)。
思思同学在总结“构造原理、能量最低原理、泡利原理、洪特规则”后得出了:“在同一原子里,没有运动状态完全相同的电子存在”的结论。
你认为此结论是否正确,请说明理由。
1996年诺贝尔化学奖授予对发现 C60有重大贡献的三位科学家。C60分子是形如球状的多面体,如右图,该结构的建立基于以下考虑:C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;C60分子只含有五边形和六边形;碳与碳之间既有单键又有双键,每个碳原子仍然满足四个价键饱和.
多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
顶点数 + 面数 - 棱边数 =" 2" 。
请回答:
(1)一个C60分子中有多少个五边形和多少个六边形?
(2)一个C60分子中有多少个C=C?
(3)已知C70分子的结构模型也遵循C60的那些规律,请确定C70分子结构中上述几项参数。
试用杂化轨道理论分析为什么BF3的空间构型是平面三角形,而NF3是三角锥形的?
你认为水的哪些物理性质与氢键有关?试把你的结论与同学讨论交流。