FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
 ClO3-+
ClO3-+ Fe2++
Fe2++ =
= Cl-+
Cl-+ Fe3++
Fe3++ .
.
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为 mg·L-1。

X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是_________________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
(4) X2M的燃烧热ΔH =-a kJ·mol-1,写出X2M燃烧反应的热化学方程式:___________________________。
(5)ZX的电子式为___________;ZX与水反应放出气体的化学方程式为____。
(6)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为: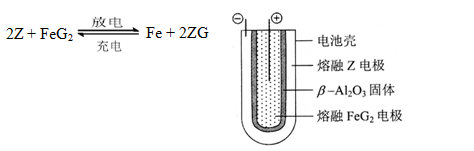
放电时,电池的正极反应式为_______________:
充电时,______________(写物质名称)电极接电源的负极;
该电池的电解质为___________________。
将CO2通入NaOH溶液中,所得产物随通入的CO2的物质的量的不同而不同。完成下列填空。
(1)250 mL 1 mol/L的NaOH溶液,最多可吸收CO2L(标准状况下)。
(2)向250 mL 2 mol/L的NaOH溶液中通入一定量CO2,溶液增重4.4 g,将所得溶液蒸干,计算所得固体中各成分的物质的量。
向未知浓度、体积为V L的 NaOH溶液中缓缓通入一定体积(标准状况下)的CO2,充分反应后,在减压低温的条件下蒸发溶液,得到白色固体。
(3)若反应中CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成m1 g 白色沉淀。
①根据以上数据,用代数式表示CO2的体积V(CO2)=。
②根据以上数据,推理计算出NaOH溶液的浓度范围。
(4)写出确定NaOH浓度的实验步骤,并用代数式表示NaOH溶液的浓度。(设计实验方案时,只能用题中提供的CO2和NaOH溶液,不得使用其它化学试剂。)
实验步骤:。c(NaOH)=。
苯巴比妥是安眠药的成分,化学式为C12H12N2O3,分子结构中有两个六元环:下图是以A为原料合成苯巴比妥的流程示意图。完成下列填空。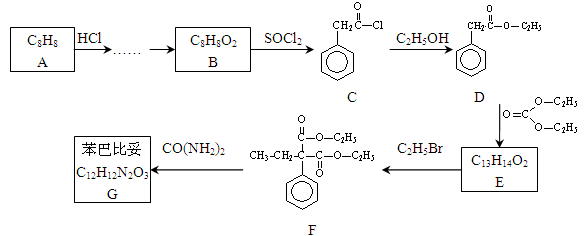
已知:①有机物D、E中亚甲基(—CH2—)的氢原子受羰基影响活性较高,容易发生如下反应: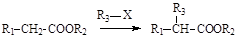
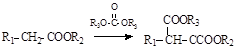
②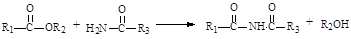
(1)芳香烃A与HCl反应后,制取B还需进行反应的类型依次为。
(2)一种酯与B互为同分异构体,且苯环上只有一个取代基,该酯同分异构体有种,写出其中一种结构系统命名。
(3)写出D 转化为E的化学方程式:
(4)苯巴比妥G的结构简式:
(5)E与CO(NH2)2在一定条件下合成的高分子结构简式:
(6)已知: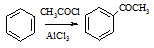 ,请设计合理方案以B的同系物
,请设计合理方案以B的同系物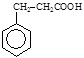 为原料合成
为原料合成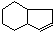 (用合成路线流程图表示为:A
(用合成路线流程图表示为:A B……
B…… 目标产物)。
目标产物)。
碳酸二甲酯(DMC)是一种低毒性的绿色化学品,可用于代替高毒性的光气(COCl2)作羰基化试剂。DMC的合成路线如下图。完成下列填空。
已知:RCOOR’ + R’’ OH → RCOOR’’ + R’OH
(1)写出反应类型:反应①反应③
(2)石油工业上获得C2H4的操作名称为。
(3)写出结构简式:DMC; X
(4)已知物质Y与DMC互为同分异构体,Y的水溶液呈酸性,在一定条件下2 molY能生成1mol分子中含六元环结构的有机物,则Y的结构简式为:
(5)DMC与双酚(  )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:。
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:。
为了回收利用钢铁生产过程中产生的SO2,工业上采用软锰矿(主要成分MnO2)脱硫同时制取硫酸锰技术,其流程示意图如下:
已知:浸出液的pH接近4,其中的金属离子主要是Mn2+,还含有少量的Fe2+。完成下列填空。
(1)写出浸出过程中主要反应的化学方程式:。
(2)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将(“有利”、“不利”)于软锰矿浆继续吸收SO2。欲消除生成的硫酸,试剂A最好是。
a.MnCO3 b.MnO2 c.CaO d.CaCO3
(3)操作I的目的是除去浸出液中的Fe2+,MnO2在氧化Fe2+的同时还,使Fe3+沉淀。检验过滤后溶液中是否含有Fe3+的操作是。
(4)已知大于27℃时,MnSO4·H2O溶解度随温度上升而明显下降,则操作II的过程为:、、洗涤、干燥。工业上为了充分利用锰元素,在流程中可循环使用。
(5)通过煅烧MnSO4·H2O 可制得生产软磁铁氧体材料的MnxO4,如图是煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。该曲线中A段所表示物质的化学式为;MnxO4中x=。