用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.10 L 0.l mol∙L-1的Na2CO3溶液中离子总数一定大于3NA |
| B.标准状况下,22.4 L HF的分子数为NA |
| C.1 mol Fe在22.4 L的Cl2(标准状况下)中燃烧,转移的电子总数为3NA |
| D.一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA |
对于反应2A(g)+B(g) 2C(g)△H<0,下列图象正确的是()
2C(g)△H<0,下列图象正确的是()
一定温度下,在一定容的密闭容器中充入NO2发生如下反应:2NO2 N2O4并达到平衡,此时NO2的转化率为P%,再次充入NO2,其转化率将()
N2O4并达到平衡,此时NO2的转化率为P%,再次充入NO2,其转化率将()
| A.增大 | B.减小 | C.不变 | D.无法确定 |
下列说法中可以说明2HI(g)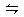 H2(g)+I2(g)已达到平衡状态的是()
H2(g)+I2(g)已达到平衡状态的是()
(1)单位时间内生成n mol H2的同时生成n mol HI
(2)一个H—H键断裂的同时有两个H—I键断裂
(3)c(HI)= c(I2)
(4)反应速率υ(H2)=υ(I2)=0.5υ(HI)
(5)c(H2)∶c(I2)∶c(HI)=2∶1∶1
(6)温度和体积一定时,某一生成物浓度不再变化
(7)温度和体积一定时,容器内压强不再变化
(8)条件一定,混合气体的平均相对分子质量不再变化
(9)温度和体积一定时,混合气体的颜色不再发生变化
(10)温度和压强一定时,混合气体的密度不再发生变化
某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:
|
|
请回答以下问题:
(1)为验证气体A,按右图所示进行实验:若能
|
|
有关的离子反应方程式为 ,有人
提出上述方法中出现白色沉淀并不能充分说明火| 实验次数 |
H2O2溶液质量分数% |
H2O2溶液用量/毫升 |
物质D用量/克 |
反应温度/℃ |
收集气体体积/毫升 |
所需时间/秒 |
| ① |
30 |
5 |
0 |
85 |
2 |
3.8 |
| ② |
15 |
2 |
0.1 |
20 |
2 |
2.8 |
| ③ |
15 |
2 |
0.2 |
20 |
2 |
2.2 |
| ④ |
5 |
2 |
0.1 |
20 |
2 |
7.4 |
| ⑤ |
30 |
5 |
0 |
55 |
2 |
10.5 |
由上表可知,实验①和⑤能证明温度越高,化学反应速率越快,实验 和 证明物质D的用量越大,反应速率越快。
(6)写出步骤①中发生反应的化学方程式 。
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做()
| A.阴极 | B.阳极 | C.正极 | D.负极 |