七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣﹣硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4•7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 .
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 .
(每空2分,共22分)
I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L · s)]与反应时间t(s)的关系如图所示。回答如下问题: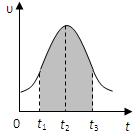
(1)该反应的化学方程式:
(2)0→t2时间段内反应速率增大的原因是:,
(3)t2→t时间段内反应速率减小的原因是:,
(4)图中阴影部分“面积”表示t1→t3时间里。
A.Mn2+物质的量浓度的增大B.Mn2+物质的量的增加
C.SO42-物质的量浓度D.MnO4-物质的量浓度的减小
II.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如上图甲可观察,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是。
(2)定量分析:如上图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为,实验中需要测量的数据是
(3)加入0.01mol MnO2粉末于60mL H2O2溶液中,在标准状况下放出气体体积和时间的关系如图所示。设放出气体的总体积为V mL。
①放出V/3 mL气体时所需时间为min。
②该H2O2溶液的浓度为
③A、B、C、D各点反应速率快慢的顺序为>>>
(14分) 某小组准备在实验室中制取干燥、纯净的氯气并验证氯气的性质,设计了如下的实验装置图:
(一) 制取纯净的氯气
(1)写出A中反应的化学方程式:____________________________________.
(2)B中加入的物质是:___________________作用是:___________________.
(3)C中加入的物质是:___________________作用是:___________________.
(4)E中反应方程式为:_____________________________________________.
(二) 验证氯气的性质: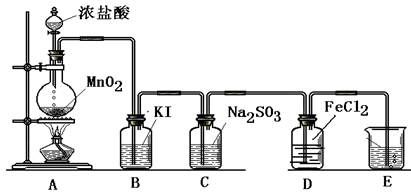
(5)B中发生反应的方程式为:_______________________________________.
(6)C中发生反应的方程式为:______________________________________.
(7)D中的反应方程式为:__________________________________________.
从今年3月16日下午开始,大陆“海水受日本核辐射污染,碘可防辐射”等消息疯传,从绍兴、宁波、台州地区开始出现抢盐潮,接着蔓延到多个城市,人们抢购加碘盐是因为食盐中添加了碘元素。
I.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100mg碘,假设此碘盐碘元素含量为40 mg/kg,要达到上述碘含量要求,需服用该碘盐kg,你觉得服用碘盐防辐射合理吗?
II.如图为某加碘盐标签的一部分。
已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移
至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
| 编号 |
碱式滴定管读数 |
消耗体积(mL) |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
0 |
如图一 |
|
| 2 |
0 |
23.98 |
23.98 |
| 3 |
0 |
24.02 |
24.02 |
(1)第一次读数为mL。
(2)滴定终点的判断方法。
(3)经过计算,此加碘盐碘元素的含量为mg/kg(用包含a、b的最简表达式表示)。
(4)下列操作可能会导致测量结果偏低的是。
| A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g |
| B.步骤1所配食盐溶液未完全转移至锥形瓶 |
| C.步骤2中滴定管洗涤后未润洗 |
| D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
(共13分)叠氮化合物应用广泛,如NaN3,可用于汽车安全气囊,PhCH2N3可用于合成化合物V(见下图,仅列出部分反应条件,Ph-代表苯基 )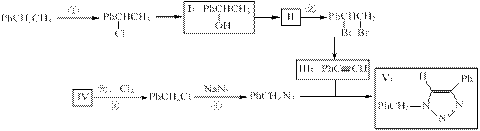
(1)下列说法不正确的是(填字母)。
A.反应①、④属于取代反应
B.化合物I可生成酯,但不能发生氧化反应
C.一定条件下化合物Ⅱ能生成化合物I
D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
(2)化合物Ⅱ发生聚合反应的化学方程式为(不要求写出反应条件)
(3)反应③的化学方程式为(要求写出反应条件)
(4)化合物Ⅲ与PhCH2N3发生环加成反应生成化合物V,不同条件下环加成反应还可生成化合物V的同分异构体。该同分异构体的分子式为
,结构简式为。
(5)科学家曾预言可合成C(N3)4。其可分解成单质,用作炸药。有人通过NaN3与NC-CCl3反应成功合成了该物质。下列说法正确的是(填字母)
A.该合成反应可能是取代反应
B.C(N3)4与甲烷具有类似的空间结构
C.C(N3)4不可能与化合物III发生环加成反应
D.C(N3)4分解爆炸的化学反应方程式可能为:C(N3)4→C+6N2↑
(共17分) (1)下图是用KMnO4 与浓盐酸反应制取适量氯气的简易装置。
装置B、C、D的作用分别是:
B____________________C_________________D
(2)在实验室欲制取适量NO气体。
①下图中最适合完成该实验的简易装置是_________(填序号);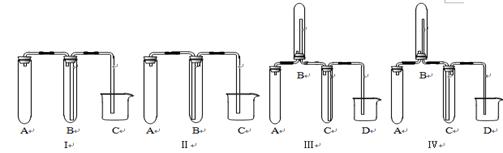
②根据所选的装置完成下表(不需要的可不填):
| 应加入的物质 |
所起的作用 |
|
| A |
||
| B |
||
| C |
||
| D |
③简单描述应观察到的实验现象:A中_______,,。B中。