下列实验过程中产生沉淀的物质的量(Y) 与加入试剂的量(X)之间的关系正确的是
| A.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡 |
| B.向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 |
| C.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量 |
| D.向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量 |
把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。
最先观察到酚酞变红的现象的区域是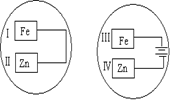
| A.I和III | B.I和IV |
| C.II和III | D.II和IV |
一种燃料电池利用在酸性溶液中甲醇与氧气作用生成水和二氧化碳。该电池负极发生的反应是
| A.CH3OH(g)+O2(g)==H2O(l)+CO2(g)+2H+(aq)+2e- | B.O2(g)+4H+(aq)+4e-==2H2O(l) |
| C.CH3OH(g)+H2O(l)==CO2(g)+6H+(aq)+6e- | D.O2(g)+2H2O(1)+4e-="=" 4OH- |
如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是 
| A.Cu极附近OH-浓度增大 |
| B.Cu极为原电池负极 |
| C.电子流向是由C极流向Pt极 |
| D.当C极上有4 mol电子转移时,Pt极上有1 mol O2生成 |
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用.锌锰碱性电池以KOH溶液为电解液,电池总反应式为:Zn+2MnO2+2H2O==Zn(OH)2+2MnOOH下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2+2H2O+2e-==2MnOOH+2OH- |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g |
一个原电池的总反应方程式为Zn+Cu2+==Zn2++Cu,该原电池可能为
| A |
B |
C |
D |
|
| 正极 |
Cu |
Al |
Zn |
Fe |
| 负极 |
Zn |
Zn |
Cu |
Zn |
| 电解质溶液 |
H2SO4 |
CuSO4 |
ZnCl2 |
CuCl2 |