下列离子方程式正确且能解释事实的是
| A.SO2使紫色石蕊溶液变红色:SO2+H2O═2H++SO32- |
| B.向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成: Ca2++HCO3-+OH-═CaCO3↓+H2O |
| C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后变蓝: 4H++4I-+O2═2I2+2H2O |
| D.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+ Fe2++ 14H+= 2Cr3++ Fe3++ 7H2O |
下列烷烃与氯气只发生一氯取代,得到3种不同沸点产物的是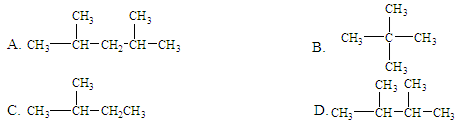
下列化学用语正确的是
A. 聚丙烯的结构简式为: 聚丙烯的结构简式为: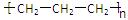 |
B.丙烷分子的比例模型为: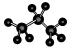 |
C.四氯化碳分子的电子式为: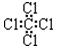 |
D.2,3-二甲基-4-乙基己烷的键线式: |
有机物 的正确命名为
的正确命名为
| A.2-乙基-3,3-二甲基戊烷 | B.3,3-二甲基-4-乙基戊烷 |
| C.3,3,4-三甲基已烷 | D.3,4,4-三甲基已烷 |
下列变化属于化学变化的是
①钝化②煤的气化③煤的干馏④石油的裂化⑤石油的分馏
| A.全是 | B.除②③外 | C.除②⑤外 | D.除⑤外 |
有机化学知识在生活中应用广泛,下列 说法不正确的是
说法不正确的是
| A.甘油加水作护肤剂 |
| B.医用酒精的浓度为75% |
| C.福尔马林是甲醛的水溶液,具有杀菌防腐能力因此可以用其保鲜鱼肉等食品 |
| D.苯酚有毒但可以制成药皂,具有杀菌消毒的功效 |