水资源非常重要,联合国确定2003年为国际淡水年。海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多,如反渗透法、水合物法、电渗透法和压渗法等。下列方法中,不可以用来进行海水淡化的是
| A.过滤法 | B.蒸馏法 | C.膜分离法 | D.离子交换法 |
一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g) ⇌nC(g),达到平衡后,测得A气体的浓度为0.5mol/L。保持温度不变将容器的容积扩大1倍,再达平衡时,测得A气体的浓度为0.3mol/L,则下列叙述中正确的是()
| A.x+y<n | B.该化学平衡向右移动 |
| C.B的转化率增大 | D.C的体积分数减小 |
一定温度下,在一容积固定容积的密闭容器中,通入1molX和3molY,在一定条件下发生如下反应:X(g)+3Y(g)⇌2Z(g),到达平衡后,Y的转化率为a%,然后再向容器中通入3molX,当达到新的平衡时,Y的转化率为b%。则a与b的关系是()
| A.a=b | B.a>b | C.a<b | D.不能确定 |
已知25℃时有关弱酸的电离平衡常数:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.77×l0–5 |
4.9×l0–10 |
Ki1=4.3×l0–7Ki2=5.6×l0–11 |
下列选项错误的是
A.等物质的量浓度的各溶液pH关系为:
pH(NaCN)>pH(Na2CO3)>pH(NaHCO3)>pH(HCOONa)
B. 2CN– +H2O + CO2 →HCN + CO32–
C. 等物质的量浓度的HCN溶液与NaOH溶液等体积混合后溶液中:c(OH–)>c(H+),c(Na+)>c(CN–)
D.NaHCO3和Na2CO3混合液中,一定有c(Na+)+ c(H+)=c(OH–)+ c(HCO3–) +2c(CO32–)
下表是不同pH环境时某浓度铬酸(H2CrO4)溶液中,离子浓度(mol/L)与pH的关系,下列说法错误的是
| pH |
c(CrO42—) |
c(HCrO4—) |
c(Cr2O72—) |
c(H2CrO4) |
| 4 |
0.0003 |
0.1040 |
0.4480 |
0 |
| 6 |
0.0319 |
0.0999 |
0.4370 |
0 |
| 7 |
0.2745 |
0.0860 |
0.3195 |
0 |
| 9 |
0.9960 |
0.0031 |
0.0004 |
0 |
A.铬酸第一级电离方程式为H2CrO4 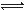 H++HCrO4—
H++HCrO4—
B.要得到CrO42—应控制溶液的pH>9
C.当电离达到平衡时,2v(正)(HCrO4—)= v(逆)(Cr2O72—)
D.该铬酸溶液的物质的量浓度约为1.00mol/L
铬(Cr)与铝的性质相似,如Cr(OH)3+OH—→CrO2—+2H2O,下列推断中错误的是
| A.往CrCl3溶液加入过量NaOH溶液不可制得Cr(OH)3 |
| B.对CrCl3·6H2O加热脱水可得CrCl3 |
| C.Cr2O3既能溶于盐酸,又能溶于氢氧化钠溶液 |
| D.CrO2—水解使溶液显碱性 |