设NA为阿伏加德罗常数的值,则下列说法正确的是
| A.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA |
| B.向NH4Al(SO4)2稀溶液中逐滴加入过量Ba(OH)2溶液,离子方程式为: NH4++Al3++2SO42-+ 2Ba2++ 5OH-=2BaSO4↓+ AlO2-+ 2H2O+NH3•H2O |
| C.常温下,由水电离出的H+浓度为10-13mol·L-1的溶液中,Fe2+、Cl-、Na+、NO3-可能大量共存 |
| D.葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+ 可以大量共存 |
pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4︰1的体积比混合,则混合溶液中H+浓度为(单位:mol·L-1)()
A.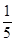 ×(4×10-9+1×10-12) ×(4×10-9+1×10-12) |
B.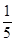 ×(8×10-9+1×10-12) ×(8×10-9+1×10-12) |
| C.5×10-10 | D.5×10-12 |
有人曾建议用AG表示溶液的酸度(acidity arede),AG的定义为AG=lg([H+]/[OH-])。下列表述正确的是()
| A.在25℃时,若溶液呈中性,则pH=7,AG=1 |
| B.在25℃时,若溶液呈酸性,则pH<7,AG<0 |
| C.在25℃时,岩溶液呈碱性,则pH>7,AG>0 |
| D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH) |
某温度下,重水D2O的离子积为1.6×10-15,若用pH一样的定义来规定pD=-lgc(D+),以下关于pD的叙述正确的是()
| A.中性溶液的pD=7.0 |
| B.含0.01 mol的NaOD的D2O溶液1L,其pD=12.0 |
| C.溶解0.01 mol的DCl的D2O溶液1L,其pD=2.0 |
| D.在100 mL 0.25 mol·L-1的DCl重水溶液中,加入50 mL 0.2mol·L-1的NaOD的重水溶液,其pD=1.0 |
某酸溶液的pH=1,此酸溶液的物质的量浓度()
| A.0.1 mol·L-1 |
| B.一定大于0.1 mol·L-1 |
| C.若为强酸一定等于0.1 mol·L-1,若为弱酸一定大于0.1 mol·L-1 |
| D.若为强酸一定≤0.1 mol·L-1,若为弱酸一定>0.1 mol·L-1 |
下列说法中正确的是()
| A.100 mL pH=3的盐酸和醋酸溶液,与足量锌反应时,起始时二者产生氢气的速率基本相等 |
| B.100 mL 1 mol·L-1的盐酸和50 mL 2 mol·L-1的盐酸分别与足量的锌反应,两者放出氢气的速率和质量均相等 |
| C.100 mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量相等 |
| D.100 mL 0.1 mol·L-1的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量是后者放出氢气质量的2倍 |