常温下,pH=1的某溶液A中还含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示: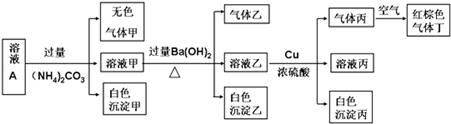
下列有关说法正确的是
| A.沉淀乙一定有BaCO3,可能有BaSO4 |
| B.实验消耗Cu 14.4 g,则生成气体丙为3.36L |
| C.该溶液A中一定有NO3-、Al3+、SO42-、Cl- |
| D.生成的甲、乙、丙气体均为无色的易溶于水气体 |
单斜硫和正交硫是硫的两种同素异形体。
已知:①S(s,单斜) + O2(g)="==" SO2(g);△H1=-297.16kJ·mol-1
②S(s,正交) + O2(g) ="==" SO2(g);△H2=-296.83kJ·mol-1下列说法正确的是()
| A.S(s,单斜)===S(s,正交);△H3 = -0.33kJ·mol-1 |
| B.单斜硫比正交硫稳定 |
| C.相同物质的量的正交硫比单斜硫所含有的能量高 |
| D.②式表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量多296.83kJ |
将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知。通入CH4的一极,其电极反应式是:CH4 + 10OH――8e-===CO32-+7 H2O;通入O2的另一极,其电极反应式是:2O2 + 4H2O + 8e-="==" 8OH-下列叙述正确的是()
| A.通入CH4的电极为正极 |
| B.该电池使用一段时间后无需补充KOH |
| C.燃料电池工作时,溶液中的OH-向正极移动 |
| D.负极发生氧化反应 |
下列各组离子因发生氧化还原反应而不能大量共存的是()
| A.Ba2+、Cl-、SO32- | B.NH4+、Al3+、OH- |
| C.Na+、H+、CO32- | D.I-、H+、Fe3+ |
下列化学方程式书写正确的是()
A. 乙醇催化氧化制取乙醛: CH3CH2OH+O2 乙醇催化氧化制取乙醛: CH3CH2OH+O2 CH3CHO+H2O CH3CHO+H2O |
B.苯与浓硫酸、浓硝酸的混合液共热制硝基苯: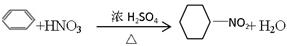 |
C.乙酸 和乙醇发生反应生成乙酸乙酯: 和乙醇发生反应生成乙酸乙酯:CH3CH2OH + CH3COOH  CH3COOC2H5 CH3COOC2H5 |
| D.乙烯使酸性高锰酸钾溶液褪色: |
5CH 2=CH2 + 12 MnO4-+ 36H+ →10CO2 +12 Mn2+ + 28H2O
2=CH2 + 12 MnO4-+ 36H+ →10CO2 +12 Mn2+ + 28H2O
短周期元素X、Y、Z在元素周期表中的位置如右下图所示,下列说法正确的是()
| A.X、Y、Z三种元素中,单质在常温下均为气态 |
| B.Z的氢化物的稳定性比Y的强 |
| C.Y的最高正化合价为+5 |
| D.Y的单质的熔点比Z的低 |