一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g) 2SO3(g) ∆H=-196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) ∆H=-196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
| 反应时间/min |
n(SO2)/mol |
n(O2)/mol |
| 0 |
2 |
1 |
| 5 |
1.2 |
|
| 10 |
|
0.4 |
| 15 |
0.8 |
|
下列说法不正确的是
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1 ·min−1
B.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C.该温度,反应的平衡常数为11.25L·mol-1
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
一个多边形的内角和是720°,这个多边形的边数是( )
| A.4 | B.5 | C.6 | D.7 |
在平面直角坐标中,点P(﹣3,5)在( )
| A.第一象限 | B.第二象限 | C.第三象限 | D.第四象限 |
下列图形中,是中心对称图形的是( )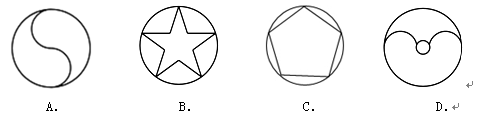
发射一枚炮弹,经过x秒后炮弹的高度为y米,x,y满足y=ax2+bx,其中a,b是常数,且a≠0.若此炮弹在第6秒与第14秒时的高度相等,则炮弹达到最大高度的时刻是( )
| A.第8秒 | B.第10秒 | C.第12秒 | D.第15秒 |
某校要从甲、乙、丙、丁四名学生中选拔一名参加区组织的“我的中国梦”演讲比赛,经过校内多轮选拔赛每名学生的平均成绩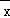 与方差S2如下表所示.如果要选择一个平均成绩高且发挥稳定的人参赛,则这个人应是( )
与方差S2如下表所示.如果要选择一个平均成绩高且发挥稳定的人参赛,则这个人应是( )
| 甲 |
乙 |
丙 |
丁 |
|
 |
8 |
9 |
9 |
8 |
| S2 |
1 |
1 |
1.2 |
1.3 |
A.甲 B.乙 C.丙 D.丁