元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
| 族 周期 |
I A |
II A |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
| 3 |
11 Na 钠 22.99 |
12Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(1)请从上表中查出关于硼元素的一条信息:_____________________。
(2)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的 相同。
(3)第11号元素与第17号元素组成的化合物是 ,构成该物质的微粒是 (选填“分子”、“原子”或“离子”)。
(4)下图A、B、C是三种粒子的结构示意图.试回答下列问题:
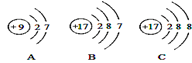
①A、B、C中属于同种元素的粒子是 ;
②A和B两种粒子的 相同,所以它们具有相似的化学性质;
针对苏教版化学I第75页上“铁与氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为+2价铁的化合物,如果与氧化性较强的氧化剂(如氯气、双氧水等)反应则转化为+3价的化合物”的叙述,化学研究性学习小组拟通过以下实验探究“新制的还原性铁粉和盐酸的反应(铁过量)”。请你参与探究并回答有关问题: (1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是:;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方
(1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是:;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方 程式:。
程式:。 (2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假 设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式。
设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式。 (3)探究高铁酸钾的某种性质。
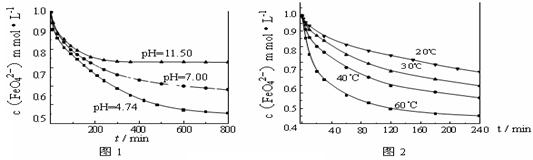
(3)探究高铁酸钾的某种性质。 【实验1】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
【实验1】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。


 【实验2】将适量 K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0 mmol·L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
【实验2】将适量 K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0 mmol·L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则 ①实验1的目的是;
①实验1的目的是; ②实验2可得出的结论是;
②实验2可得出的结论是; ③高铁酸钾在水
③高铁酸钾在水 中的反应为4 FeO42—+10 H2O
中的反应为4 FeO42—+10 H2O 4 Fe(OH)3+8OH—+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是。
4 Fe(OH)3+8OH—+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是。
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。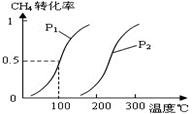
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)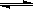 CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
①已知100℃时达到平衡所需的时间为5min,
②则用H2表示的平均反应速率为_。图中的P1_ _P2(填“<”、“>”或“=”),
100℃时平衡常数为_ _。
_。
③在其它条件不变时降低温度,逆反应速率将_ _(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)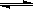 CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④ 该反应的△H_ _0,△S_ _0(填“<”、“>”或“=”)。
该反应的△H_ _0,△S_ _0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是_ _。
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中。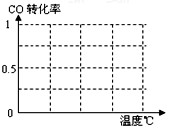
| l实验编号 |
lT(℃) |
ln (CO)/n(H2) |
lP(MP) |
| lⅰ |
l150 |
l1/3 |
l0.1 |
| lⅱ |
l__ |
l__ |
l5 |
| lⅲ |
l350 |
l__ |
l5 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
阅读下列信息,推断元素,并按要求回答相应问题:
元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、Q、M、R分别代表某一化学元素。请用所给元素回答下列问题。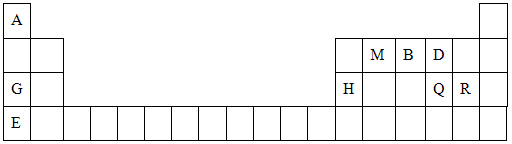
(1)Q元素在元素周期表中的位置,E元素原子结构示意图为_____
(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)_________________________________。
(3)M、D两元素形成的化合物中含有的化学键类型是,其MD2分子的结构式:。
(4)用表中所给元素组成反应物,用化学方程式说明元素Q和R非金属性的强弱:
;元素G、H的金属性强弱:
A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应又能和烧碱反应;⑥F与C同主族。用化学符号或化学用语回答下列问题:
(1)用电子式表示下列物质A2C2,DCA_________________;
(2)用电子式表示D与F形成化合物的过程;
(3)用“化学式”和“<或>”比较:A与C、A与F形成化合物的稳定性;沸点的高低 ,沸点高低的原因 ;
(4)写出E与烧碱反应的离子方程式。