已知部分弱酸的电离平衡常数如下表:
| 弱酸 |
醋酸 |
次氯酸 |
碳酸 |
亚硫酸 |
| 电离平衡常数(25℃) |
Ka=1.75ⅹ10-5 |
Ka=2.98ⅹ10-8 |
Ka1=4.3ⅹ10-7 Ka2=5.61ⅹ10-11 |
Ka1=1.54ⅹ10-2 Ka2=1.02ⅹ10-7 |
下列离子方程式正确的是
A.少量的CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO32-+2HclO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-=SO32-+2HCO3-
D.相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++ HCO3-=CO2↑+2H2O
1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成3种不同的一氯取代物。该烃的结构简式是()
A.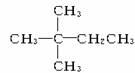 |
B.CH3CH2CH2CH2CH3 |
C.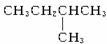 |
D.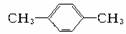 |
下列选项中说明乙醇作为燃料的优点的是()
①燃烧时发生氧化反应②充分燃烧的产物不污染环境③乙醇是一种再生能源④燃烧时放出大量热量
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
有关物质结构的叙述正确的是()
| A.有较强共价键存在的物质熔沸点一定很高 |
| B.由电子定向移动而导电的物质是金属晶体 |
| C.只含有共价键的物质不一定是共价化合物 |
| D.在离子化合物中不可能存在非极性共价键 |
三聚氰胺的结构如图所示,关于该化合物的说法正确的是()
A.含有苯环结构
B.各元素原子的结构位置相同
C.分子式为N6H6
D.各氮的质量分数为三分之二
D.水解
室温下,将小苏打投入足量水中,下列过程不会发生的是()
| A.溶解 | B.分解 | C.离解 | D.水解 |