某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
由此可知原溶液中
| A.原溶液中c(Fe3+)="0.2" mol·L-1 |
| B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1 |
| C.SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 |
| D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入足量酸性高锰酸钾溶液,若溶液紫红色褪去,则证明原溶液中有Fe2+ |
足量的两份铝粉分别与等体积的NaOH溶液和稀硫酸反应,同温同压下产生等体积的气体,则NaOH溶液和稀硫酸的物质的量浓度之比为
| A.3:2 | B.2:3 | C.1:3 | D.1:1 |
设NA表示阿伏加德罗常数的值,下列说法错误的是
| A.常温常压下,32gO2和O3的混合气体所含原子数为2NA |
| B.将7.1g氯气通入足量水中发生反应,所转移的电子数为0.1NA |
| C.标准状况下,11.2LSO2中含有的分子数为0.5NA |
| D.23g钠与足量氧气充分反应,转移的电子数一定是NA |
下列能达到实验目的的是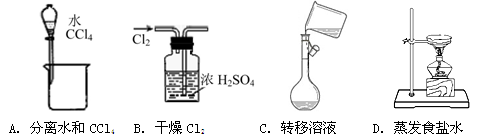
把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量之比为1:2.则已反应的Fe3+和未反应的Fe3+的物质的量之比为
| A.1:1 | B.1:2 | C.1:3 | D.2:3 |
下列物质中,不能做漂白剂的是
| A.SO2 | B.Ca(ClO)2 | C.NaClO | D.H2SO4 |