将0.02 molNa分别投入到盛有100 mL水、100 mL 1mol·L-1盐酸、100 mL 1mol·L-1硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是
| A.三个烧杯中一定均会发生的离子反应有:2Na+2H2O=2Na++2OH-+H2↑ |
| B.三个烧杯中钠均在液面上剧烈反应,相比而言,X烧杯中的反应平缓些 |
| C.Z烧杯中一定会有沉淀生成,但沉淀不是单质铜 |
| D.三个烧杯中生成氢气的物质的量相同 |
在C2H2、C6H6、C2H4O组成的混合物中,已知氧元素的质量分数为8%,则混合物中碳元素的质量分数是()
| A.92.3% | B.87.6% | C.75% | D.84% |
某烃在光照条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是()
A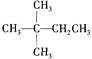 B CH3CH2CH2CH3 C
B CH3CH2CH2CH3 C D CH3-
D CH3- -CH3
-CH3
NA为阿伏加德罗常数,下列说法正确的是()
| A.标准状况下,11.2L的戊烷所含的分子数为0.5NA |
| B.28g乙烯所含共用电子对数目为4NA |
| C.标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA |
| D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
与丙烯具有相同的碳、氢百分含量,但既不是同系物又不是同分异构体的是()
| A.环丙烷 | B.环丁烷 | C.乙烯 | D.丙烷 |
分离下列混合物,应选用蒸馏操作的是()
| A.汽油和柴油 | B.溴水 | C.硝酸钾和氯化钠的混合物 | D.四氯化碳和水 |