在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g) 2NH3(g) △H=﹣92.4 kJ/mol)
2NH3(g) △H=﹣92.4 kJ/mol)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol N2、3mol H2 |
2mol NH3 |
4mol NH3 |
| NH3的浓度(mol·L-1) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
α1 |
α2 |
α3 |
下列说法正确的是
A.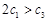 B.
B.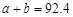 C.
C. D.α1+α2﹥1
D.α1+α2﹥1
右图所示实验装置中,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠。从a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应(已知钠与水反应生成NaOH和H2)。下列对此实验的说法中,不正确的是
| A.所充氯气应用向上排空气法收集 |
| B.反应中,烧瓶内产生大量白色烟雾 |
| C.玻璃导管只起到定位加入钠和水的作用 |
| D.烧瓶中Cl2可能参与四个反应 |
12 mol·L-1的盐酸50 mL与足量的MnO2在加热条件下反应,可以制得的Cl2的物质的量为
| A.0.3 mol | B.小于0.15 mol |
| C.在0.15 mol到0.3 mol之间 | D.0.15 mol |
某同学用下图所示装置制备并检验Cl2的性质。下列说法正确的是 ( )
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗 |
| B.Ⅱ图中:充分光照后,量筒中剩余气体约10 mL(条件相同) |
| C.Ⅲ图中:生成蓝色的烟,若在集气瓶中加入少量水,溶液呈绿色 |
| D.Ⅳ图中:干燥的有色布条不褪色,湿润的有色布条能褪色,说明Cl2有漂白性 |
鉴别氯水和盐酸两种物质时,最合适的试剂是 ( )
| A.硝酸银溶液 | B.碘化钾淀粉溶液 |
| C.碳酸钠溶液 | D.酚酞溶液 |
用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是( )
| A.漂白粉被氧化了 |
| B.有色布条被空气中的氧气氧化了 |
| C.漂白粉跟空气中的CO2反应充分,生成了较多量的HClO |
| D.漂白粉溶液蒸发掉部分水,其浓度增大 |