将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正确的是
| A.O~A段反应的化学方程式是Ba(OH)2+CO2=BaCO3↓+H2O |
| B.A~B段反应的离子方程式是2OH-+CO2=CO32-+H2O |
| C.A~B段与C~D段所发生的反应相同 |
| D.D~E段沉淀的减少是由于碳酸钡固体的溶解所致 |
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O=6Cu+SO2↑,关于该反应的说法中,正确的是
| A.该反应的氧化剂只有Cu2O |
| B.Cu2S在反应中既是氧化剂,又是还原剂 |
| C.Cu既是氧化产物又是还原产物 |
| D.每生成19.2g Cu,反应中转移0.6 mol电子 |
硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是
| A.1∶3 | B.2∶3 | C.1∶1 | D.4∶3 |
用0.1 mol / L的Na2SO3溶液30 mL,恰好将2×10-3 mol的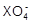 还原,则元素X在还原产物中的化合价是
还原,则元素X在还原产物中的化合价是
| A.+1 | B.+2 | C.+3 | D.+4 |
由相同条件下的三个反应:2A +B2 ="2B" +A2;2C +A2 ="2A" +C2;2B +D2 ="2D" +B2;
可判断
| A.氧化性:A2>B2>C2>D2 |
| B.还原性:C->A->B->D- |
| C.2A-+ D2 = 2D-+A2不能进行 |
| D.2C-+B2 =2B-+C2不能进行 |
用下列方法均可制得氧气:
(1)2KClO3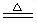 2KCl+3O2↑
2KCl+3O2↑
(2)2HgO 2Hg+O2↑
2Hg+O2↑
(3)2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为
| A.3∶1∶4 | B.2∶1∶1 | C.1∶1∶1 | D.1∶2∶2 |