已知I﹣、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Fe2+<H2O2<I﹣<SO2,则下列反应不能发生的是
| A.2Fe3++SO2+2H2O═2Fe2++SO42﹣+4H+ |
| B.H2O2+H2SO4═SO2+O2+2H2O |
| C.I2+SO2+2H2O═H2SO4+2HI |
| D.2Fe3++H2O2═2Fe2++O2↑+2H+ |
高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为
2Fe(OH)3 + 3KClO + 4KOH ="=" 2K2FeO4 + 3KCl + 5H2O,下列说法正确的是
| A.制备高铁酸钾用ClO-作还原剂 |
| B.制备高铁酸钾时1 mol Fe(OH)3得到3 mol 电子 |
| C.高铁酸钾中铁的化合价为+7 |
| D.用高铁酸钾处理水时,其还原产物能水解产生具有强吸附能力的胶体 |
类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中,错误的是( )
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色
④密度为1.1 g·cm-3与密度为1.2 g·cm-3的NaCl溶液等体积混合,所得NaCl溶液的密度介于1.1 g·cm-3与1.2 g·cm-3之间,Na-K合金的熔点应介于Na和K熔点之间
| A.①② | B.①④ | C.①②③④ | D.①②④ |
实验室将NaClO3和Na2SO3按物质的量之比1∶2倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
| A.Cl2 | B.Cl2O | C.ClO2 | D.Cl2O3 |
常温下,在溶液中可发生以下反应:① H++Z-+XO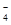 === X2++Z2+H2O(未配平),
=== X2++Z2+H2O(未配平),
② 2M2++R2===2M3++2R-,③ 2R-+Z2=== R2+2Z-。由此判断下列说法正确的是
| A.常温下反应2M2++Z2===2M3++2Z-不可以自发进行 |
| B.R元素在反应②中被氧化,在③中被还原 |
| C.反应①配平后,H2O的化学计量数为8 |
| D.还原性强弱顺序为:X2+>Z->R->M2+ |
下列离子组在一定条件下能共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是
| 选项 |
离子组 |
加入试剂 |
加入试剂后发生反应的离子方程式 |
| A |
Fe2+、NO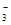 、K+ 、K+ |
稀硫酸 |
3Fe 2++NO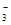 +4H+===3Fe3++NO↑+2H2O +4H+===3Fe3++NO↑+2H2O |
| B |
Fe3+、I-、ClO- |
氢氧化钠溶液 |
Fe3++3OH-===Fe(OH)3↓ |
| C |
Ba2+、HCO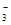 、Cl- 、Cl- |
氢氧化钠溶液 |
HCO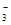 +OH-===CO +OH-===CO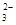 +H2O +H2O |
| D |
Al3+、Cl-、NO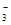 |
过量氢氧化钠溶液 |
Al3++3OH-===Al(OH)3↓ |