A、B、C、D均为中学化学所学的常见物质,它们之间的转化关系如下列各图所示(部分反应条件或产物已略去).请按要求回答下列问题:
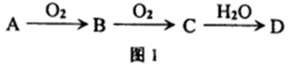
(1)若A、B、C、D均含有同一种短周期元素X,它们的转化关系如图l所示:
①常温下,若A为化合物,C为红棕色气体,D为强电解质,则X所在周期表中的位置是 ;用方程式表示A溶于水,使酚酞变红的原因: .
②常温下,若A为固体单质,D为强电解质,则D可能的化学式为 、 .符合上述条件且含有离子键的C的电子式: .
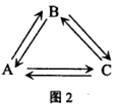
(2)若A、B、C均含有同一种短周期元素Y,它们的转化关系如图2所示:
若Y的周期数等于主族序数;盐A溶液显酸性:盐B溶液显碱性,且焰色反应为黄色;C为两性氢氧化物。请用离子方程表示B溶液显碱性的原因: ;在实验室里,欲使A溶液中的阳离子全部沉淀出来转化为C,所发生化学反应的离子方程式为_____________。
(本部选作)(15分)化合物F是一种抗心肌缺血药物的中间体,可以通过以下方法合成: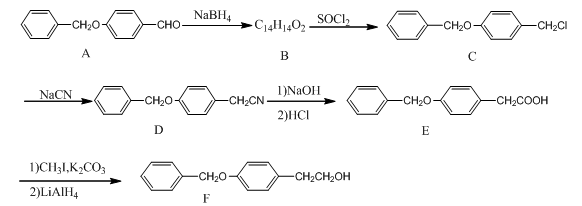
(1)化合物C中的官能团为______________和________________(填官能团的名称)。
(2)化合物B的结构简式为_____________;由A→B的反应类型是:____________。
(3)同时满足下列条件的A的同分异构体有______________种。试写出一种分子中只含有6种等效氢的结构简式:_____________________。
①分子含有2个独立苯环,无其他环状结构
②能发生银镜反应和水解反应
③不能和FeCl3发生显色反应,但水解产物可以,分子中含有甲基
(4)(4)已知: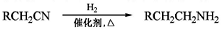 ,请写出以
,请写出以 为原料制备化合物X(
为原料制备化合物X(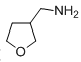 )(结构简式见右图)的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:____________________
)(结构简式见右图)的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:____________________
以下均为中学化学常见物质,存在如下转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
(1)G的化学式 ;F的电子式
(2)反应②的离子方程式 ;
(3)写出另外一种实验室制取H的化学方程式 ;
(4)D溶液中阳离子的焰色反应火焰呈 色;可用 试剂检验D溶液中大量存在的阴离子。
(8分)现有A、B、C、D四种短周期元素, A分别与B、C、D结合生成甲、乙、丙三种化合物, 且甲、乙、丙3分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图: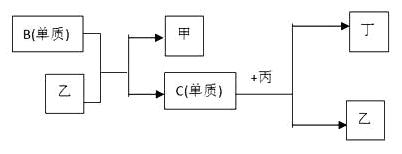
(1)写出B+乙→甲+C的化学反应方程式______________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是_______。(填写序号)
① A ② B ③ C ④ D
(3) 依据下列条件可以进一步确定上述第四种元素:
①甲与丙以及乙与丙均能够发生反应,②甲、丙、丁都是无色有刺激性气味的物质。
据此,请回答下列问题:
A.写出上述第四种元素在周期表中的位置 。
B.写出C+丙→乙+丁的化学反应方程式 。
如图所示是利用丙烯和对二甲苯合成有机高分子材料W的转化关系示意图.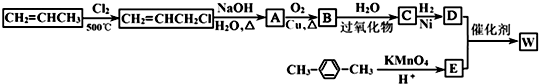
已知:①C不含甲基,B可以发生银镜反应,1molD与足量钠可生成22.4L H2(标准状况下).
① R﹣CH=CH2+H2O R﹣CH2CH2OH
R﹣CH2CH2OH
② 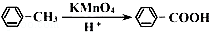
请完成下列各问:
(1)A的结构简式是 ,D的核磁共振氢谱图中有 个峰.
(2)C中所含官能团的名称 、 .
(3)C→D反应类型为 .
(4)有关物质B所具有的性质的叙述中正确的是(填序号) .
a.能发生银镜反应 b.能使溴水褪色 c.能发生酯化反应d.可发生聚合反应
(5)写出下列反应的化学方程式:
① A→B: .
② D+E→W: .
③ D的同分异构体(同一个碳原子上连接两个﹣OH的不能稳定存在)和E的同分异构体反应生成最小环酯: .
(6)物质E有多种同分异构体,请分别写出满足以下条件一个E的同分异构体的结构简式:
ⅰ.①遇FeCl3溶液显紫色 ②可发生银镜反应 ③能发生水解反应 .
ⅱ.①遇FeCl3溶液显紫色 ②可发生银镜反应 ③能和NaHCO3发生反应生成CO2 .
顺式一茉莉酮的一种合成路线如下(部分反应条件已略去,-Ph代表苯基):[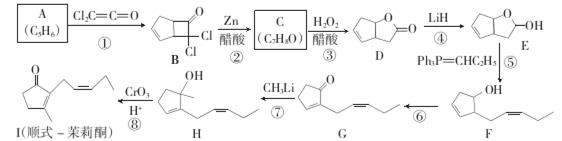
回答下列问题:
(1)化合物A的名称为 ;G与I的关系是 。
(2)C中所含官能团是 (填名称)。
(3)反应②的化学方程式为 ,②的反应类型是 ;④的反应类型是______________________
(4)G的一种同分异构体能与FeCl3溶液发生显色反应且核磁共振氢谱显示只有4组峰,则符合条件的异构体的结构简式为 (有几个写几个)。
(5)参照顺式一茉莉酮的上述合成路线,设计一条由Cl2 C=C=O和乙烯为起始原料制备聚γ一丁内酯(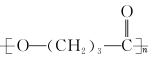 )的合成路线 。
)的合成路线 。