FeCl3、CuCl2混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
| A.加入KSCN溶液一定不变红色 |
| B.溶液中一定含有Fe2+ |
| C.溶液中一定含Cu2+ |
| D.剩余固体中一定含铜 |
利用下列反应不能制得括号中纯净物质的是:
| A.乙烯与水加成(乙醇) |
| B.乙烯与氯气加成(1,2-二氯乙烷) |
| C.氯气与苯用氯化铁作催化剂反应(氯苯) |
| D.等物质的量的氯气与乙烷在光照条件下反应(氯乙烷) |
下列事实能用同一原理解释的是:
| A.SO2和Cl2都能用于漂白 |
| B.I2、NH4Cl晶体受热都逐渐消失 |
| C.配制Fe(NO3)3和Sn(NO3)2溶液均要加入稀硝酸 |
| D.SO2可使加酚酞的氢氧化钠溶液和酸性高锰酸钾溶液的红色都褪去 |
下表为周期表的一部分,有关短周期X、Y、Z、R四种元素叙述正确的是: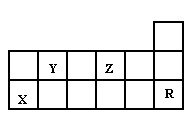
| A.热稳定性:Y的气态氢化物<Z的气态氢化物 |
| B.X的最高价氧化物对应水化物的酸性比Y的强 |
| C.X元素的单质能与所有强酸发生反应放出H2 |
| D.R元素的单质化学性质活泼 |
下列表示对应化学反应的离子方程式正确的是:
| A.玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-=Na2SiO3↓+H2O |
| B.硫酸亚铁溶液被空气中氧气氧化:4Fe2+ +O2+4H+=4Fe3+ +2H2O |
| C.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D.用食醋和淀粉-KI试纸检验碘盐中的KIO3IO3-+5I-+6H+=3I2+3H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是:
| A.能使淀粉-KI试纸显蓝色的溶液中:K+ SO42- S2- SO32- |
| B.含有0.1mol·L-1 Fe2+的溶液:Na+Cl- ClO- SO42- |
| C.c(H+)/c(OH-)=1012的溶液中:Al3+ NH4+ NO3- K+ |
| D.含有0.1mol·L-1 HCO3-的溶液:Na+ Fe3+ NO3- C6H5O- |