设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,11.2L HF中含有分子的数目为0.5NA |
| B.0.1molFe与少量氯气反应生成FeCl2,转移电子数为0.2NA |
| C.1.4g 由乙烯和环丙烷组成的混合物中含有原子的数目为 0. 3NA |
| D.0.1 mol·L-1碳酸钠溶液中含有CO32-离子数目小于0.1 NA |
下列物质能使KMnO4酸性溶液褪色,不能使溴水褪色的是( )
| A.苯 | B.丙烯 | C.二甲苯 | D.己烷 |
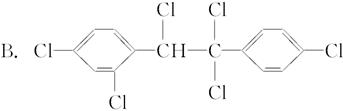
六氯苯是被联合国有关公约禁止或限制使用的有毒物质之一。下式中能表示六氯苯的是( )


CaC2、MgC2、Al4C3都是离子化合物,下列叙述不正确的是( )
| A.MgC2、Al4C3都能跟水反应生成乙炔 |
B. 的电子式为 的电子式为 |
| C.它们与水的反应属于水解反应 |
| D.Al4C3与水反应可得到甲烷 |
下列实验能获得成功的是( )
| A.乙醇与4 mol·L-1的硫酸混合加热到170 ℃制乙烯 |
| B.苯与浓溴水反应制取溴苯 |
| C.重油在常压下分馏可得石蜡、润滑油等 |
| D.电石与饱和食盐水作用制乙炔 |
据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为:HC≡C—C≡C—C≡C—C≡N。对该物质判断正确的是( )
| A.晶体的硬度与金刚石相当 |
| B.能使高锰酸钾酸性溶液褪色 |
| C.不能发生加成反应 |
| D.可由乙炔和含氮化合物加聚制得 |