已知HA的酸性比HB的酸性强。现有物质的量浓度和体积均相同的NaA和NaB两种溶液,已知前者溶液中离子数目为n1,后者溶液中离子数目为n2。下列关系正确是
| A.n1=n2 | B.n1>n2 |
| C.n1<n2 | D.c(A—)<c(B—) |
下列元素的原子在形成不同物质时,既能形成离子键,又能形成极性键和非极性键的是()。
| A.Na | B.Mg | C.Ne | D.Cl |
下列物质中的离子键最强的是()。
| A.KCl | B.CaCl2 | C.MgO | D.Na2O |
某化合物的分子式为AB2,该分子是否为极性分子取决于( )。
| A.键的极性 | B.键的空间排列 |
| C.键的极性和空间排列 | D.都不是 |
判断下列分子为手性分子的是( )。
A.CH2Cl2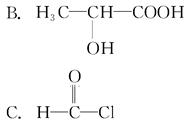
D.CH3CH2COOCH2CH3
用一带静电的玻璃棒靠近A、B两种纯液体流,根据图分析,这两种液体分子的极性正确的是( )。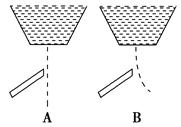
A.A是极性分子,B是非极性分子
B.A是非极性分子,B是极性分子
C.A和B都是极性分子
D.A和B都是非极性分子