今有①盐酸、②醋酸、③硫酸三种稀溶液,用序号回答下列问题。
(1)若三种酸的物质的量浓度相等。
a.三种溶液中的c(H+)大小关系为__________________。
b.取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小关系为 。
c.若取等质量Zn分别跟这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积大小关系为 。
(2)若三种酸溶液中的c(H+)相等。
a.三种酸的物质的量浓度大小关系为__________________。
b.取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为 。
C.取等质量Zn分别跟这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积大小关系为 。
有机物A的结构简式为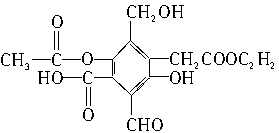
(1)A与过量NaOH完全反应时,A与参加反应的NaOH物质的量之比为____________。
(2)A与新制Cu(OH)2完全反应时,A与参加反应的Cu(OH)2物质的量之比为_________,其中A与被还原的Cu(OH)2的物质的量之比为__________。
(3)A与过量NaHCO3完全反应时,A与参加反应的NaHCO3物质的量之比为___________。
在浓硫酸催化下,某羧酸8.6g完全酯化需乙醇4.6g,此羧酸能与溴发生加成反应,此羧酸是()
| A.CH3CH="=CHCOOH" | B.CH3CH2CH2COOH |
C.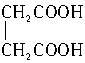 |
D.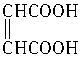 |
某有机物能发生银镜反应,滴入石蕊试液不变色,则该有机物为()
| A.甲酸 | B.乙醛 | C.甲酸乙酯 | D.乙酸乙酯 |
有以等物质的量混合的饱和一元酸和某饱和一元酯形成的混合物1 mol,其充分燃烧时需2 mol O2,该混合物的组成可能有以下几种情况:①___________;②___________;③___________。
酸奶中含有乳酸,其结构简式为
CH3—CH(OH)—COOH。
(1)乳酸跟足量金属钠反应的化学方程式为:_______________________________________。
(2)乳酸跟少量碳酸钠溶液反应的化学方程式为:_________________________________。
(3)乳酸在浓硫酸的存在下,3分子相互反应,生成物为链状,其结构简式可表示为:
______________________________________________________________________________。
(4)乳酸在浓硫酸存在下,2分子相互反应,生成物为环状,其结构简式为:
______________________________________________________________________________。