将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是
| A.KSCN | B.BaCl2 | C.NaOH | D.HCl |
下列有关物质的性质、应用等的说法中正确的是
| A.浓硫酸久置于空气中体积不会变化 |
| B.二氧化硫具有漂白性,与氯水混合使用效果更好 |
| C.合金的熔点可以低于它的成分金属 |
| D.Fe(OH)3胶体的本质特征是能产生丁达尔效应 |
安全是顺利进行实验及避免伤害的保障。下列实验操作正确且不是从实验安全角度考虑的是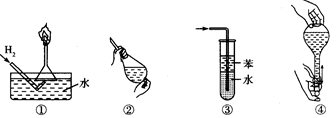
| A.操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度 |
| B.操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出 |
| C.操作③:吸收氨气或氯化氢气体并防止倒吸 |
| D.操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水 |
下列有关氧化还原反应的叙述正确的是
| A.在一定条件下能发生反应:3O2=2O3,该反应不属于氧化还原反应 |
| B.氧化反应一定先于还原反应发生 |
| C.氧化性强的物质与还原性强的物质接触一定能发生反应 |
| D.氧化剂本身一定只发生还原反应 |
电解硫酸溶液时,放出25mL(标况)O2,若以等量的电量在同样条件下电解盐酸溶液,
所放出的气体的体积最接近下列数据中的
| A.45mL | B.50mL | C.75mL | D.100mL |
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O=O dkJ·mol—1。
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
| A.(4c+12b-6a-5d)kJ·mol—1 |
| B.(6a+5d-4c-12b)kJ·mol—1 |
| C.(4c+12b-4a-5d)kJ·mol—1 |
| D.(4a+5d-4c-12b)kJ·mol—1 |