(1)写出砷的元素符号 ,原子中所有电子占有__________个轨道,核外共有_________个不同运动状态的电子。
(2)写出Ni的元素名称 ,该元素在周期表的位置为第 周期,第 族。
(3)第四周期基态原子中未成对电子数最多的元素是 ,该元素基态原子的价电子轨道表示式为 。
(4)第三电子层上有__________个能级,作为内层最多可容纳_________个电子,作为最外层时,最多可含有__________个未成对电子。
根据下列化学实验示意图及表中实验现象,能得出正确结论的是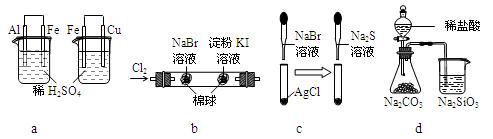
| 选项 |
实验 |
实验现象 |
结论 |
| A |
a |
左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
| B |
b |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
| C |
c |
白色固体先变为淡黄色,后变为黑色 |
溶解性:AgCl < AgBr< Ag2S |
| D |
d |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
有X、Y、Z、W、M五种短周期元素,其中X、 Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2-
>W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法正确的是
| A.X、M两种元素只能形成X2M型化合物 |
| B.Y、Z两元素的气态氢化物中,Y的气态氢化物更稳定 |
| C.Z、W两元素的最高价氧化物对应水化物的酸性:Z > W |
| D.W、M两元素的某些单质或化合物可作为自来水消毒剂 |
已知A、B、C、D、E分别为Ca(OH)2、Ca (HCO3)2、HCl、Ba(NO3)2、Na2CO3五种溶液中的一种。现将它们相互反应情况列表如下(表中“↓”表示生成沉淀;“↑”表示生成气体; “—”表示无现象)据此可判断C是
(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种溶液中的一种。现将它们相互反应情况列表如下(表中“↓”表示生成沉淀;“↑”表示生成气体; “—”表示无现象)据此可判断C是
A.HClB.Ca(HCO3)2C.Na2CO3D.Ba(NO3)2
某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液 的变化如图所示。下列判断正确的是
的变化如图所示。下列判断正确的是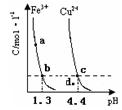
A.加适量浓NH3·H2O可使溶液由 点变到 点变到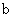 点 点 |
B.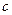 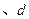 两点代表的溶液中 两点代表的溶液中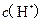 与 与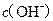 乘积不相等 乘积不相等 |
C.Cu(OH)2在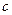 点比在d点代表的溶液中溶解程度小 点比在d点代表的溶液中溶解程度小 |
D.该温度下,氢氧化铁的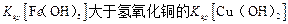 |
已知A、B、C是单质,其中C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略),下列判断不正确的是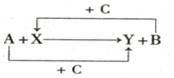
A.A 是铝,B是铁 B.A 是碳,B是硅
C.A 是氢气,B是铜 D.A 是钠,B是氢气