用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
| A.若无固体剩余,则溶液中一定有Fe3+ |
| B.若有固体存在,则溶液中一定有Fe2+ |
| C.若溶液中有Cu2+,则一定没有固体析出 |
| D.若溶液中有Fe2+,则一定有Cu析出 |
3种钙盐的溶解度随溶液pH的变化如下图所示(图中纵坐标是钙离子浓度的对数),从中可知钙盐在人体中最稳定的存在形式是( )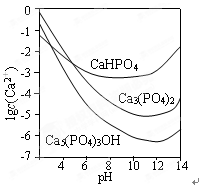
| A.Ca5(PO4)3OH | B.Ca3(PO4)2 | C.CaHPO4 | D.Ca(H2PO4)2 |
下列各组物质由于浓度不同而能发生不同氧化还原反应的是()
①Cu与HNO3溶液;②NaOH与AlCl3溶液;③Zn与H2SO4溶液;④Na与O2反应
| A.①③ | B.①②③ | C.②③④ | D.①④ |
同时加热氯化镁晶体(MgCl2·6H2O)和硫酸镁晶体(MgSO4·7H2O)时,氯化镁易发生水解反应,其原因是( )
| A.氯化镁水解是熵增反应 | B.硫酸镁晶体分解反应是放热反应 |
| C.硫酸镁晶体分解反应是熵减反应 | D.氯化镁分解放热比硫酸镁少 |
下列说法中,正确的是()
①同种元素的原子的性质相同
②能自发进行的化学反应,不一定是△H<0 、△S>0
③胶体与溶液的本质区别是胶体具有丁达尔现象
④ Ksp不仅与难溶电解质的性质和温度有关,而且与溶液中的离子浓度有关
⑤“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
⑥食盐可以融冰化雪,用食盐作融雪剂不会对环境、植物生长产生任何危害
| A.①③④ | B.①④⑥ | C.②⑤ | D.①⑤ |
下列各反应中,生成物总能量比反应物总能量高的是()
| A.电解饱和食盐水 | B.铁生锈 | C.木炭燃烧 | D.工业合成氨 |