下列有关离子方程式书写正确的是
| A.向氯化铝溶液中滴加少量氨水:Al3++3OH—=Al(OH)3↓+ 2H2O |
| B.向氯化铁溶液中加入过量的锌粉:Zn + 2Fe3+ =2Fe2+ + Zn2+ |
| C.以铁为电极电解NaCl溶液时,阳极的电极反应:Fe-3e— =Fe3+ |
| D.硝酸亚铁溶液中滴入浓盐酸:3Fe2++ 4H+ + NO3—=3Fe3+ + NO↑+2H2O |
有机物的种类繁多,但其命名是有规则的。下列有机物命名正确的是
A. 1,4-二甲基丁烷 1,4-二甲基丁烷 |
B. 3-甲基丁烯 3-甲基丁烯 |
C. 2-甲基丁烷 2-甲基丁烷 |
| D.CH2Cl-CH2Cl二氯乙烷 |
下列化学用语正确的是
| A.乙烯分子的最简式:CH2 | B.己烷的分子式:C6H12 |
| C.羟基的化学式:OH- | D.1,2—二溴乙烷的结构简式:C2H4Br2 |
化学与科技、社会、生产、生活等关系密切,下列有关说法不正确的是
| A.部分卤代烃可用作灭火剂 |
| B.福尔马林(甲醛溶液)可用于浸泡生肉及海产品以防腐保鲜 |
| C.提倡人们购物时不用塑料袋,是为了防止白色污染 |
| D.石油分馏是物理变化,可得到汽油、煤油和柴油等产品 |
反应A2(g)+2B2(g) 2AB2(g)的ΔH<0,下列说法正确的是
2AB2(g)的ΔH<0,下列说法正确的是
| A.升高温度,正反应速率增加,逆反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
可逆反应aX(g)+bY(g)  cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)—时间(t)图象如图。下列说法正确的是
cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)—时间(t)图象如图。下列说法正确的是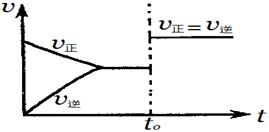
| A.若a+b=c,则t0时只能是增大反应体系的压强 |
| B.若a+b=c,则t0时只能是加入催化剂 |
| C.若a+b≠c,则t0时只能是加入催化剂 |
| D.若a+b≠c,则t0时只能是增大反应体系的压强 |