Ⅰ、甲醛是深受关注的有机化合物。甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠。
(1)将4.00 mL甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,用浓度为1.100 mol ·L―1的硫酸滴定,至终点时耗用硫酸20.00 mL。甲醛水溶液的浓度为 mol ·L―1。上述滴定中,若滴定管规格为50mL,甲醛水溶液取样不能超过 mL。
(2)甲醛可和新制氢氧化铜的反应发生反应的化学方程式通常表示如下:HCHO + 2Cu(OH)2 HCOOH + Cu2O↓ + 2H2O在该反应中体现了甲醛的 (填“氧化性”、“还原性”)每1mol甲醛参加反应转移的电子数为 个。甲醛中的碳的杂化方式为 。(填sp、sp2、sp3)
HCOOH + Cu2O↓ + 2H2O在该反应中体现了甲醛的 (填“氧化性”、“还原性”)每1mol甲醛参加反应转移的电子数为 个。甲醛中的碳的杂化方式为 。(填sp、sp2、sp3)
Ⅱ、硝酸在工业及科研上常用于物质的制备。
实验室常用稀硝酸与铜反应制取干燥且较纯的一氧化氮,现设计如下实验。按下图连接好装置并检查气密性,在A中加入0.5g碳酸钙粉末,再加入20.0 mL 5.0 mol ·L―1的稀硝酸,片刻后塞上胶塞,将铜丝插入稀硝酸中。


① 从右图中选择合适的装置接入上图虚线框中,则a接 、 接b(填连接的字母)。
② 当观察到 现象时,表明NO已收集满,立即将铜丝抽离液面。
A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,其余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,从A—I的所有物质之间有如下的转化关系:
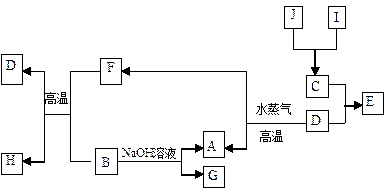
 (1)写出下列物质的名称A;G。
(1)写出下列物质的名称A;G。 (2)写出下列反应的化学方程式:
(2)写出下列反应的化学方程式: ①B+F→D+H:;
①B+F→D+H:; ②D→A+F:;
②D→A+F:; ③B→A+G:。
③B→A+G:。 (3)将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是
(3)将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是 。
。
A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题: (1)B与D形成化合物BD2的结构式为,B元素形成的同素异形体的晶体类型可能是。
(1)B与D形成化合物BD2的结构式为,B元素形成的同素异形体的晶体类型可能是。 (2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式 。FD2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式
。FD2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式
为___________________________________________。 (3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为__________________________________________;
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为__________________________________________;
由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)______________________________。 (4)C2A4 ─ 空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:正极的电极反应式是______________________________________。
(4)C2A4 ─ 空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:正极的电极反应式是______________________________________。
试回答下列问题:
⑴指出下列实验用品或仪器(已洗涤干净)使用时的第一步操作:
①石蕊试纸(检验气体性质)
②容量瓶 (2)下列实验中所选用的仪器或操作以及结论合理的是____________。
(2)下列实验中所选用的仪器或操作以及结论合理的是____________。
A.用托盘天平称量5.85 g氯化钠晶体 |
B.仅用蒸馏水和pH试纸,就可以鉴别pH相等的H2SO4溶液和CH3COOH溶液 |
C.用碱式滴定管量取25.00 mL高锰酸钾溶液 |
D.不宜用瓷坩埚灼烧氢氧化钠、碳酸钠 |
 E. 量筒内液体体积读数为10.0 mL时,全部倒入烧杯内的实际体积也是10.0 mL
E. 量筒内液体体积读数为10.0 mL时,全部倒入烧杯内的实际体积也是10.0 mL F. 100 mL容量瓶内液面正好达到刻度线时,全部倒入烧杯内的实际体积也必为100 mL
F. 100 mL容量瓶内液面正好达到刻度线时,全部倒入烧杯内的实际体积也必为100 mL (3)欲量取15.00 mL Na2CO3溶液,应选用的仪器是_________________。
(3)欲量取15.00 mL Na2CO3溶液,应选用的仪器是_________________。 (4)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行___________次。
(4)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行___________次。
已知:A、E是非金属固体单质,气体F能使品红溶液褪色,C分子中有22个电子。A—H有如下转化关系(有部分产物略去):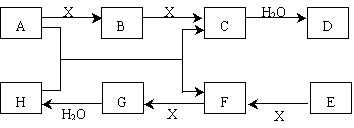
请回答:
(1)C的化学式 该分子的电子式为:。
该分子为: (填极性、非极性)分子。
F的化学式 。
(2)X的一种同素异形体与人类生存环境密切相关,该物质的化学式是,
X转化成它的方程式是:。
(3)单质A与单质E化合生成的物质的化学式为。
(4)写出A+H→C+F的化学反应方程式并标出电子转移的方向和数目:
。
某些化学反应可用下式表示
A + B─→ C + D + H2O
请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应
的离子方程式:。
(2)若C为氯化钠,D能使澄清石灰水变浑浊的无味气体,则A与B的组合
是:或。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合
是。