(5分)实验室有一瓶浓硫酸,瓶上标签内容如图所示,请你根据标签上提供的数据解答下列问题。

(1)用20mL浓硫酸可以配制溶质质量分数为10%的稀硫酸 g。
(2)利用刚配制好的稀硫酸测定某二价金属(R)的纯度:取8g该不纯金属粉末(所含有的杂质不与酸反应,也不溶解于水),再取刚配好的溶液98g混合至恰好完全反应后过滤,
将滤液蒸干,得到粉末状固体质量为15.2g。
①金属R发生反应的化学方程式为 ;
②利用已知条件求解反应生成氢气质量(x)的比例式为 ;
③该金属的纯度为 ;
④若反应后的溶液只含有一种溶质,将反应后所得溶液小火缓慢蒸发3.4g水(蒸发水的过程中没有晶体析出),则最终溶液中溶质的质量分数为 。
实验室制取气体所需的装置如下图所示。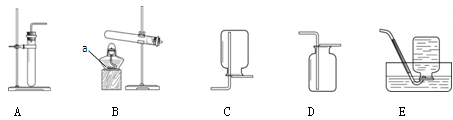
(1)实验仪器a的名称是________。
(2)实验室制取二氧化碳的化学方程式为,所选用的发生和收集装置为(填字母序号)。用过氧化氢溶液和二氧化锰制取氧气的化学方程式为____________。
(3)用高锰酸钾制取氧气时,用E装置收集氧气完成后,接下来的实验步骤是,该反应的化学方程式为________________________________________。
金属与人类的生产生活息息相关。
(1)下列金属制品中,利用金属导电性的是_________(填字母序号)。


A.铁锅 B.铜导线 C.水龙头
(2)金属腐蚀造成资源浪费,铁生锈的条件是 。
(3)应用金属活动性顺序能帮助我们进一步学习金属性质。已知下列各组物质间均能发生化学反应。
A.Fe和CuSO4溶液 B. Mg和MnSO4溶液 C. Mn和FeSO4溶液
①写出Fe和CuSO4溶液反应的化学方程式 。
②以上四种金属的活动性由强到弱的顺序是。
(4)化学小组对含有硫酸铜和硫酸锌的废液进行了如下处理: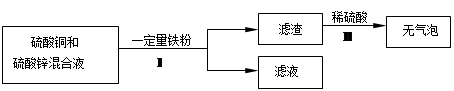
①步骤Ⅰ中的操作名称是___________。
②滤液的成分是(写出所有可能)。
在宏观、微观和符号之间建立联系是化学学科的特点。化肥对提高粮食产量具有重要的作用。尿素[CO(NH2)2]是一种常用的化肥,工业上生产尿素的反应的微观示意图如下: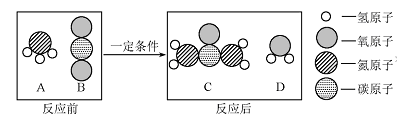
(1)尿素由种元素组成,B物质的化学式为。
(2)A、B、C、D四种物质均由构成(填“分子”、“原子”或“离子”)。
(3)四种物质中属于氧化物的有(填字母序号)。
(4)生产尿素的反应中,A与 B的微粒个数比为。
(5)若要生产30 g 尿素,则需要A的质量为g。
食品与健康、能源与环境是我们共同关注的社会问题。
(1)红枣,自古以来就被列为“五果”之一。红枣中含有蛋白质、脂肪、维生素A、维生素C、微量钙、铁等。
①这里的“铁”、“钙”是指(填字母序号)。
A.原子 B.分子C.元素D.单质
②人体缺铁,会导致(填“贫血”或“佝偻病”)。
(2)煤、和天然气属于化石燃料。天然气是汽车使用的燃料之一,其主要成分燃烧的化学方程式为。
(3)“三效催化转化器”可以将汽车尾气中的二氧化氮和一氧化碳处理为空气中的两种无毒气体,该反应的化学方程式为。
水是最常见的物质之一。如图是电解水实验的示意图:
(1)写出该反应的化学方程式。
(2)检验试管b中气体的方法。
(3)下列关于电解水的说法中不正确的是。
| A.水分子发生了改变 |
| B.氢原子和氧原子没有发生变化 |
| C.水是由氢元素和氧元素组成 |
| D.水分子是化学变化中最小的微粒 |
(4)已知相同条件下氧气在水中的溶解能力大于氢气,则在实验中试管a、b收集到的气体体积比2:1(填“大于”、“小于”或“等于”)。
(5)水能与氧化钙反应,该反应的化学方程式为,此反应热量。