下列图示与对应的叙述不相符的是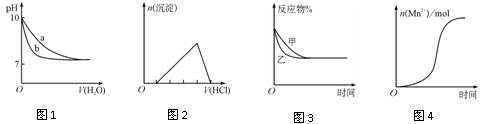
| A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线 |
| B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系 |
C.图3表示压强对可逆反应CO(g)+H2O(g)  CO2(g)+H2(g)的影响,乙的压强比甲的压强大 CO2(g)+H2(g)的影响,乙的压强比甲的压强大 |
| D.图4表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) |
在C(HCO3-)="0.1" mol·L-1的溶液中, 可以大量共存的离子组是( )
| A.Ca2+、NO3-、NH4+、Cl | B.Na+、SO42-、C1、Ca2+ | C.H+、Ba2+、Cl、NO3- | D.Cl、CO32、Na+、OH- |
下列离子方程式正确的是()
| A.NaHCO3溶液中加足量石灰水:HCO3- + OH- + Ca2+ = CaCO3↓ + H2O |
| B.钠与水反应:Na + 2H2O = Na+ + 2OH- + H2↑ |
| C.铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag |
| D.铁片投入稀盐酸中:2Fe + 6H+ = 2Fe3+ + 3H2↑ |
将Al2(SO4)3和(NH4)2SO4的混合溶液a L分为两等份,其中一份加入bmol的BaCl2,恰好使溶液中的SO42-完全沉淀;另一份加入足量强碱并加热可得到cmolNH3,则原溶液中的Al3+的浓度(mol/L)为( )
| A.(2b-c)/2a | B.(2b-c)/a | C.(2b-c)/3ª | D.(4b-2c)/3a |
一化学兴趣小组在家中进行化学实验,按照下图连接好线路发现灯泡不亮,按照右图连接好线路发现灯泡亮。
由此得出的结论正确的是( )
| A.NaCl是非电解质 |
| B.NaCl溶液是电解质 |
| C.NaCl在水溶液中电离出了可以自由移动的离子 |
| D.NaCl溶液中,水电离出大量的离子 |
已知 2Fe3+ +2I- =2Fe2+ +I2、 2Fe2+ +Cl2=2Fe3+ +2Cl- ;则有关离子的还原性由强到弱的顺序为( )
| A.Cl->Fe2+>I- | B.Fe2+>I->Cl- |
| C.I->Fe2+>Cl- | D.Fe2+>Cl->I- |