在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为0.65g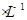 。现用氯氧化法处理,发生如下反应(其中N均为一3价、O均为-2价):
。现用氯氧化法处理,发生如下反应(其中N均为一3价、O均为-2价):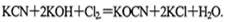 该反应中,被氧化的元素是___________,氧化产物是_______________。
该反应中,被氧化的元素是___________,氧化产物是_______________。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请用单线桥法标出电子转移方向和数目: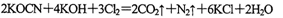
(3)若处理上述废水20.0 L,使KCN完全转化为无毒物质,至少需液氯___________g.
(4)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中—种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:_____________(已知:氯元素最高化合价为+7价)
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)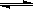 CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图所示:
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图所示:
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为。
②图中的P1P2(填“<”、“>”或“=”),100℃时平衡常数为。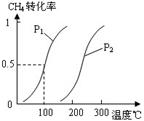
(2)在压强为0.1 MPa条件下, a mol CO与 3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)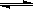 CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
③该反应的△H0,△S0(填“<”、“>”或“=”)。
④若容器容积不变,下列措施可增加甲醇产率的是
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1mol CO和3mol H2 |
(3)在最新开发并投入生产的流动电解质直接甲醇燃料电池中,流动电解质硫酸的使用,可提高燃料电池效率约30%,该电池的负极反应为。
T℃时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6mol A和3mol B,发生反应如下:3A(g)+b B(g)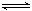 3C(g)+2D(g),
3C(g)+2D(g), ;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=_________,化学方程式中计量数b=________。
(2)乙容器中反应达到平衡所需时间t_________4min(填“大于”、“小于”或“等于”),原因是___________________________________________________________。
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8mol/L,起始时,向丙容器中加入C、D的物质的量分别为3mol、2mol,则还需加入A、B的物质的量分别是___________、___________。
请按要求完成下列反应的式子。
(1)银锌纽扣电池(总反应:Ag2O+Zn= 2Ag+ZnO,电解质溶液:氢氧化钾)的正极反应:______________________________________________________
(2)电解以下溶液:
A. 当电解质溶液为硝酸银溶液、阳极材料为银、阴极材料为铜的阳极反应:______________________________________________________
B. 当电解质溶液为氯化钠溶液、阳极阴极材料均为石墨的阴极反应:
______________________________________________________
C. 将A中的阳极材料改为石墨,其它条件不变时的电解总反应:
______________________________________________________
(3)请你任选一种离子,这种离子既能电离又能水解,分别写出其电离与水解的离子方程式:
电离:______________________________________________________
水解:______________________________________________________
(4)已知每分解1g NH4NO3晶体放出0.53 kJ(298K,101KPa)热量,同时生成笑气(N2O)与液体水。请根据上述信息写出NH4NO3晶体分解的热化学方程式:______________________________________________________
(14分)我国规定饮用水质量标准必须符合下表所示要求:
| 项目 |
pH |
Ca2+、Mg2+总浓度 |
细菌个数 |
| 相关值 |
6.5~8.5 |
<0.0045mol·L-1 |
<100个·mL-1 |
下图是源水处理成自来水的工艺流程示意图。
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,在一级沉降池中所得沉淀的主要成分为和( 写化学式)。
(2)FeSO4·7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀。凝聚剂除去悬浮固体颗粒的过程__________(填写编号)。
①只是物理过程;②只是化学过程;③是物理和化学过程。
(3)通入二氧化碳的目的是和调节pH值。
(4)Cl2的作用是,这种作用是基于Cl2和水反应的产物具有性,Cl2与水反应的化学方程式为
(5)下列物质中,可以作为气体Cl2的代用品。(填写编号,多选倒扣)
①Ca(ClO)2②NH3(液)③K2FeO4④SO2
(5分) 化学对人体健康有着十分重要的作用。
(1)为提高人体素质, 食盐加碘、食物补碘已引起人们的重视。据报道, 人从食物中摄取碘后碘便在甲状腺中积存下来, 通过一系列化学反应可形成甲状腺素。甲状腺素的结构如右图:加碘食盐中碘的存在形式主要是__________(填序号);
| A.I | B.I2 | C.KI | D.KIO3 |
甲状腺素的分子式为____________。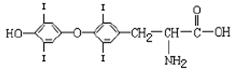
(2)某同学到了傍晚时就看不见东西,患了夜盲症,可能的原因之一是他体内缺乏_________,另一同学在刷牙时牙龈经常出血,他可能缺乏_____________,应多吃____________________。