按要求回答下列问题
(1)、4g CO在氧气中燃烧生成CO2,放出 9. 6kJ热量,写出CO燃烧的热化学方程式。_____________________________
(2)、已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________________
(3)、已知碳的燃烧热ΔH1=" a" kJ·mol-1 S(s)+2K(s)==K2S(s) ΔH2=" b" kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3=" c" kJ·mol-1
则S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH=
(4)、已知:C(s)+O2(g)=CO2(g) ΔH="-437.3" kJ·mol一1
H2(g)+1/2O2(g)=H2O(g) ΔH="-285.8" kJ·mol一1
CO(g)+1/2O2(g)=CO2(g) ΔH="-283.0" kJ·mol一1
写出煤气化(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式
计算10m3(标况)水煤气完全燃烧放出的热量为 kJ(结果保留到小数点后一位)。
在一定条件下,可逆反应:mA+nB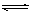 pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是。
(2)A、C是气体,增加B的量,平衡不移动,则B为态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是。
(4)加热后,可使C的质量增加,则正反应是反应(放热或吸热)。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)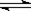 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
(1)有四种钠的化合物,根据下列反应式判断W、X、Y、Z的化学式。
W,X,Y,Z。
①W→X+CO2↑+H2O ②Z+CO2→X+O2
③Z+H2O→Y+O2↑ ④X+Ca(OH)2→Y+CaCO3↓
(2)A、B、C、D、E五种物质的焰色反应都显黄色。A、B与水反应都有气体产生,A与水反应放出的气体有氧化性,B与水反应放出的气体有还原性,同时都生成C的溶液。C与适量的CO2反应生成D,D的溶液与过量的CO2反应生成E的溶液,E加热又变为D。填写下列空白:
①B与水反应的化学方程式:。
②D的溶液与过量的CO2反应生成E的溶液反应的化学方程式:。
已知有以下物质相互转化。试回答: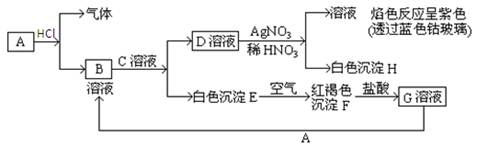
(1)写出A的化学式,B的化学式,D的化学式,F的化学式。
(2)写出由D转变成H的化学方程式。
(3)写出向G溶液加入A的有关离子反应方程式。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其余的均为短周期主族元素; ②Y原子价电子排布msnmpn ③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z的元素符号为_______,在周期表中的____分区。
(2)向Z的硫酸盐的溶液中逐滴加入R的氢化物的水溶液至过量,可观察到的现象为___________.此时Z2+与R的氢化物形成了配位数为4的配合物离子,该离子中化学键的类型有(填序号)。
A配位键 B极性共价键 C 非极性共价键 D 离子键
(3)氢化物的沸点:X的比同族其它元素高的原因是。Q和Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是_____(填序号)。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、X的第一电离能由小到大的顺序为_______________。R、X、Y四种元素的原子半径由小到大的顺序为________(均用元素符号表示)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为_____。