设NA 表示阿伏加德罗常数,数值约为6.02×1023。下列说法正确的是
| A.1 L 0.1mol·L-1的NaHCO3溶液中含有阳离子的物质的量为0.2mol |
| B.4℃时9mL水和标准状况下11.2L氮气含有相同的原子数 |
| C.在25℃,1.01×105 Pa时,11.2 L氧气所含的氧原子数目为6.02×1023 |
| D.标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L |
把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如下图。经过一段时间后,首先观察到溶液变红的区域是()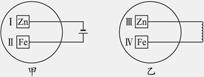
| A.Ⅰ和Ⅲ附近 | B.Ⅰ和Ⅳ附近 |
| C.Ⅱ和Ⅲ附近 | D.Ⅱ和Ⅳ附近 |
在恒温、容积为2 L的密闭容器中充入2 mol SO2和一定量O2。发生反应2SO2+O2 2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是()
2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是()
| A.等于1.6 mol | B.等于1.2 mol |
| C.大于1.6 mol | D.小于1.2 mol |
如图所示是101kPa时,氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是()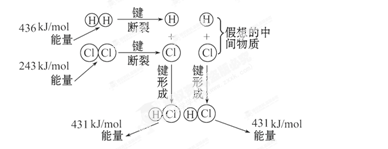
| A.此反应的热化学方程式为:H2(g)+Cl2(g) =2HCl(g) ΔH=+183kJ·mol-1 |
| B.2molHCl分子中的化学键形成时要释放862kJ能量 |
| C.1molH2中的化学键断裂时需要吸收436kJ能量 |
| D.此反应的热化学方程式为:1/2H2(g)+1/2Cl2(g) =HCl(g) ΔH=-91.5kJ·mol-1 |
在下列各说法中,正确的是()
A.对于2SO2(g)+O2(g)  2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ 2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ |
| B.热化学方程式中的化学计量数不能用分数表示 |
| C.Zn(s)+H2SO4(aq) =ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能 |
| D.ΔH的大小与热化学方程式的化学计量数无关 |
在一定条件下,A和B反应可生成C和D,其能量变化如下:
下列有关反应A+B=C+D的说法正确的是()
| A.反应前后原子的种类和数目可能改变 |
| B.该反应若有热量变化,则一定是氧化还原反应 |
| C.若该反应为放热反应,则不需加热反应就一定能进行 |
| D.该反应遵循能量守恒,所以一定有能量变化 |