羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原.25.00ml0.5mol/L羟胺的酸性溶液能与50ml0.25mol/LKMnO4酸性溶液完全作用(已知MnO4﹣被还原为Mn2+)则上述反应中羟胺的氧化产物是
| A.N2 | B.N2O | C.NO | D.NO2 |
一种碳纳米管能够吸附氢气,可做二次电池(如下图所示)的碳电极。该电池的电解质为6 mol·L-1 KOH溶液,下列说法中正确的是()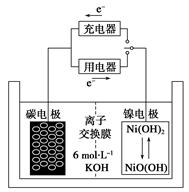
| A.充电时阴极发生氧化反应 |
| B.充电时将碳电极与电源的正极相连 |
| C.放电时碳电极反应为H2-2e-=2H+ |
| D.放电时镍电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH- |
下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是()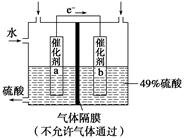
| A.该装置将化学能转化为电能 |
| B.催化剂b表面O2发生还原反应,其附近酸性增强 |
| C.催化剂a表面的反应是SO2+2H2O-2e-=SO42-+4H+ |
| D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15 |
一定条件下,碳钢腐蚀与溶液pH的关系如下:
| pH |
2 |
4 |
6 |
6.5 |
8 |
13.5 |
14 |
| 腐蚀快慢 |
较快 |
慢 |
较快 |
||||
| 主要产物 |
Fe2+ |
Fe3O4 |
Fe2O3 |
FeO2- |
下列说法不正确的是()
A.在pH<4溶液中,碳钢主要发生析氢腐蚀
B.在pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
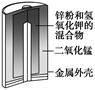
有关下列四个常用电化学装置的叙述中,正确的是()
 |
 |
 |
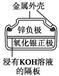 |
| 图Ⅰ 碱性 锌锰电池 |
图Ⅱ 铅硫 酸蓄电池 |
图Ⅲ 电解 精炼铜 |
图Ⅳ 银锌 纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是()
C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是()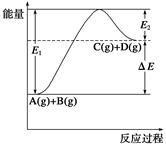
| A.该反应是放热反应 |
| B.加入催化剂后,反应加快,ΔE减小 |
| C.反应物的总键能小于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |