下列溶液中Cl-的物质的量浓度最大的是
| A.300 mL 3.5 mol/L KCl溶液 | B.1000 mL 2.5 mol/L NaCl溶液 |
| C.200 mL 2 mol/L MgCl2溶液 | D.250 mL1 mol/L AlCl3溶液 |
热激活电池可用作火箭、导弹的工作电。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是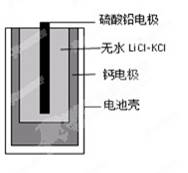
|
A. 正极反应式:Ca +2Cl--2e-=CaCl2
B. 放电过程中,Li+向负极移动迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如下图。下列叙述正确的是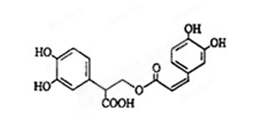
| A.迷迭香酸属于芳香烃 |
| B.1mol迷迭香酸最多能和9mol氢气发生加成反应 |
| C.迷迭香酸可以发生水解反应、取代反应和酯化反应 |
| D.lmol迷迭香酸最多能和含5mol NaOH的水溶液完全反应 |
某强氧化剂XO(OH)2+,被亚硫酸钠还原到较低价态。如果还原2.4×10-3 mol XO(OH)2+,需用30ml0.2 mol/L的亚硫酸钠溶液,还原后X的最终化合价为
| A.0 | B.+2 | C.-2 | D.+1 |
下列物质转化在给定条件下能实现的是
①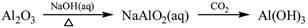
②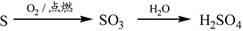
③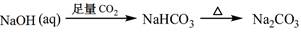
④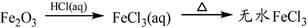
⑤
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
下列离子方程式书写正确的是
| A.Na2O2投入水中:2Na2O2+2H2O = 4Na++4OH−+ H2↑ |
| B.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O = HClO+HSO3- |
| C.钠投入CuSO4溶液中:2Na+Cu2++2H2O = 2Na++Cu(OH)2↓+H2↑ |
| D.铜和稀HNO3反应:3Cu+8H++2NO3-= 3Cu2++2NO2↑+4H2O |