下列物质:①Na ②Na2O ③NH3 ④HCl ⑤Ba(OH)2⑥NaCl ⑦蔗糖 ⑧NaCl溶液。(填序号)
(1)属于电解质的是 ,
(2)属于非电解质的是 ,
(3)能导电的是 。
(16分)氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。 利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) Fe3O4(s) + H2(g)△H="a" KJ/mol (Ⅰ)
Fe3O4(s) + H2(g)△H="a" KJ/mol (Ⅰ)
2Fe3O4(s)=6FeO(s)+ O2(g)△H="b" KJ/mol (Ⅱ)
下列坐标图分别表示FeO的转化率(图1)和一定温度时,H2生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图2)。
(1)反应:2H2O(g)=2H2(g) + O2(g)ΔH=(用含a、b代数式表示);
(2)在上述循环制氢的过程中FeO的作用是:;
(3)900°C时,在两个体积均为2L密闭容器中分别投入0.60molFeO和0.20mol H2O(g),甲容器用细颗粒FeO,乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是:;
②用细颗粒FeO时,H2O (g)的转化率比用粗颗粒FeO时H2O(g)的转化率(填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计算过程)。
(4)在坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注):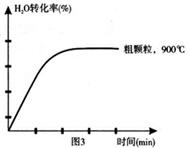
成环是有机合成的重要环节。如反应
①
化合物(Ⅰ)可由(Ⅲ)合成:
(1)(Ⅰ)的分子式为,1mol(Ⅰ)最多能与mol H2发生加成反应。
(2)写出(Ⅳ)→ A的化学方程式。
(3) 酸性条件下,化合物B能发生聚合反应,化学方程式为。
(4)化合物B→(Ⅴ)的反应类型为。
(5)(Ⅲ)与(Ⅱ)也能发生类似反应①的反应,生成含两个六元环的化合物的结构简式为______ (任写一种)
(6)下列物质与(Ⅴ)互为同分异构体的是(填序号)
高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为:
已知: Ⅰ. SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
| 沉淀完全的pH |
3.7 |
9.7 |
(1)操作①加快反应速率的措施有(写一种)。碳酸锶与盐酸反应的离子方程式。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为_______。
A.氨水B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是(填化学式)。
(5)步骤④的操作是、。
(6)工业上用热风吹干六水氯化锶,适宜的温度是。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(16分) 碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g)  CO(g) +H2(g)ΔH=" +131.3" kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是。
CO(g) +H2(g)ΔH=" +131.3" kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是。
| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
(2)已知,C(s)+ CO2(g) 2CO(g) △H=+172.5kJ•mol-1
2CO(g) △H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g) CO2(g)+H2(g)的△H=kJ•mol-1。
CO2(g)+H2(g)的△H=kJ•mol-1。
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
| t / min |
2 |
4 |
7 |
9 |
| n(H2O)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
①其它条件不变,降低温度,达到新平衡前v(逆)_____v(正)(填“>”、“<”或“=”) 。
②该温度下,此反应的平衡常数K=__________;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、“减小”或“不变”)。
某新型液晶有机物基元IV的合成线路如下: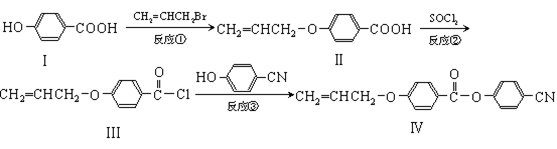
(1)Ⅰ的分子式,Ⅰ中含氧官能团的名称,反应①的类型为反应。
(2)CH2=CHCH2Br与NaOH水溶液反应的化学方程式(注明条件)。
(3)II可发生加聚反应,所得产物的结构简式。
(4)有关化合物Ⅰ和II的说法中,不正确的是。
| A.1molⅠ充分燃烧需要消耗6mol O2 | B.1molⅠ最多可消耗2mol NaOH |
| C.II能使溴的CCl4溶液褪色 | D.II能使酸性KMnO4溶液褪色 |
(5)一定条件下, 也可与III发生类似反应③的反应,生成有机物V,V的结构简式是。
也可与III发生类似反应③的反应,生成有机物V,V的结构简式是。
(6)化合物I的同分异构体中,苯环上一溴代产物只有两种,遇FeCl3溶液显紫色,还能发生银镜反应的化合物有多种,写出其中一种同分异构体的结构简式。