在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)
+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
| 温度/℃ |
25 |
80 |
230 |
| 平衡常数 |
5×104 |
2 |
1.9×10﹣5 |
下列说法不正确的是
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为2×10﹣5
Ni(s)+4CO(g)的平衡常数为2×10﹣5
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
某种气体的摩尔质量为M g·mol-1,将标况下的该气体V L溶解在1000 g水中,该气体不与水反应,所得溶液密度为ρ g·cm-3,则所得溶液中溶质的物质的量浓度为 ( )mol·L-1
| A.V/22.4 | B.V ρ/(MV+22400) |
| C.V ρ/22400 | D.1000V ρ/(MV+22400) |
A、B、C、D可能是Na2CO3、HCl、AgNO3、BaCl2四种无色溶液中的某一种,把它们两两混合后产生的现象如下表,则A、B、C、D四种物质按顺序排列正确的是
| 反应物 |
A+B |
A+C |
B+C |
C+D |
B+D |
| 现象 |
白↓ |
白↓ |
白↓ |
白↓ |
无色↑ |
A.BaCl2、 Na2CO3、 AgNO3、 HCl
B.Na2CO3、 HCl、 AgNO3、 BaCl2
C.HCl、 AgNO3、 Na2CO3、 BaCl2
D.AgNO3、Na2CO3、 BaCl2、 HCl
已知N2、CO2的混合气体的质量共9.6克,标准状况下,体积为6.72L,则该混合气体中N2和CO2的体积比为
| A.3:1 | B.1:3 | C.2:3 | D.1:2 |
下图锥形瓶中装满了c mol·Lˉ1的Na2SO4溶液,经测定其中含有a mol SO42-,则锥形瓶容积为
A.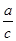 L L |
B. L L |
C.acL | D.2acL |
一定量的质量分数为14%的氢氧化钾溶液,若将其蒸发掉50 g水后,其溶质质量分数恰好扩大一倍,体积变为62.5 mL,则浓缩后溶液的物质的量浓度为
| A.2.2 mol/L | B.4 mol/L |
| C.5 mol/L | D.6.25 mol/L |