目前人类已发现的非金属元素除稀有气体外,共有16种,对这16种非金属元素的相关判断:
①都是主族元素,最外层电子数都大于4;
②单质在反应中都只能作氧化剂;
③氢化物常温下都是气态;
④氧化物常温下都可以与水反应生成酸。
其中不正确的有
| A.只有①② | B.只有①③ | C.只有③④ | D.①②③④ |
下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是
| A.CO2 | B.PCl3 | C.CCl4 | D.NO2 |
氢化钠(NaH)是一种白色晶体,NaH与水反应放出H2,下列叙述正确的是
| A.NaH在水中显酸性 | B.NaH中氢离子电子层排布与氦相同 |
| C.NaH中氢离子半径比锂离子半径小 | D.NaH中氢离子被还原为H2 |
下列不能证明反应N2(g)+3H2(g) 2NH3(g)已达到化学反应的限度的是
2NH3(g)已达到化学反应的限度的是
| A.v正(NH3)= 3v逆(H2) |
| B.1个N≡N键断裂的同时有6个N—H键断裂 |
| C.反应体系压强不再变化 |
| D.混合气体质量不再变化 |
下列指定微粒的个数比为2:1的是
| A.Be2+中的质子和电子 |
B.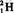 原子中的中子和质子 原子中的中子和质子 |
| C.NaHC03中的阳离子和阴离子 |
| D.BaO2(过氧化钡)固体中的阴离子和阳离子 |