有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤
称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. 试通过计算填空:
(1)A的相对分子质量为: .
(2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g,则A的分子式为: .
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况) 则A中官能团的结构简式: 、 .
(4)A的核磁共振氢谱如图:

则A中含有 种氢原子
(5)综上所述,A的结构简式 .A与浓H2SO4混合,在一定条件下反应生成六元环状物B,B的结构简式 .
 已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题: (1)X元素原子基态时的电子排布式为
(1)X元素原子基态时的电子排布式为
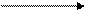 ,该元素的符号是__________;
,该元素的符号是__________; (2)Y元素原子的价层电子的轨道表示式为
(2)Y元素原子的价层电子的轨道表示式为
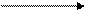 ,该元素的名称是___
,该元素的名称是___ _______;
_______; (3)X与Z可形成化合物XZ3,该化合物的空间构型为____________; X原子的杂化轨道类型为_______
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________; X原子的杂化轨道类型为_______ (4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________; (5)比较X的氢化物与同族第二、第三周期元素所形成
(5)比较X的氢化物与同族第二、第三周期元素所形成 的氢化物沸点高低顺序为
的氢化物沸点高低顺序为
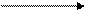 。
。
随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl细粒干燥后,准确称取mg NaCl固体并转移到定容仪器A中;
(2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积V cm3。请回答下列问题:
①步骤(1)中A仪器最好使用____________(填序号)。
| A.量简 | B.烧杯 | C.容量瓶 | D.试管 |
②步骤(2)中用酸式滴定管还是用碱式滴定管________.
③能否用水代替苯_______,理由是______________________________________。
(12分)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作: 
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
① 加热酸溶过程中发生反应的化学方程式有: 。
② 氧化剂A可选用(填编号,下同)。
A.KMnO4 B. HNO3 C. Cl2
③ 要得到较纯的产品,试剂B可选用。
A. NaOH B. CuO C.FeO
④ 试剂B的作用是。
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀
C. 降低溶液的pH D. 提高溶液的pH
⑤ 从滤液经过结晶得到氯化铜晶体的实验条件是。
(9分) 铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下: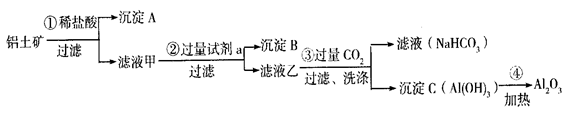
① 沉淀  A、B的成分分别是、;步骤②中的试剂a是;
A、B的成分分别是、;步骤②中的试剂a是;
② 试写出步骤③中发生反应的离子方式__________、
____________________;
③简述检验所得滤液甲 中存在Fe3+的操作方法:___________。
中存在Fe3+的操作方法:___________。
已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化关系如下,反应①~④均为化合反应。回答下列问题:
(1)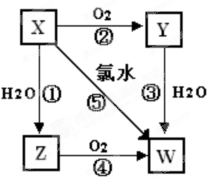
Y的化学式为___________,
Z的化学式为____________。X直接排入空气中
易造成的环境问题是_______________________。
(2)反应①~⑤中属于氧化还原反应的是_______________________________。
(3)写出反应⑤的化学方程式:_______________________________________________。
(4)写出铜与W反应的化学方程式:____________________________________________