某温度下,H2(g)+CO2(g)  H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=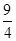 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)(mol·L-1) |
0.010 |
0.020 |
0.020 |
| c(CO2)(mol·L-1) |
0.010 |
0.010 |
0.020 |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙的反应速率最快,甲的反应速率最慢
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) 2XY3(g) △H=-92.6 kJ.mol-1
2XY3(g) △H=-92.6 kJ.mol-1
| 容器 编号 |
起始时各物质物质的量/mol |
达到平衡的时间 |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
|||
| ① |
1 |
3 |
0 |
2分钟 |
放热46.3kJ |
| ② |
0.4 |
1.2 |
1.2 |
/ |
Q(Q>0) |
实验测得反应在起始、达到平衡时的有关数据如下表所示,下列叙述不正确的是
A.容器①中反应达平衡时用XY3表示的反应速率为v(XY3)=1/30moI.L-l·s-1
B.平衡时,两个容器中XY3的物质的量浓度相等
C.容器②中反应达到平衡时吸收的热量为Q
D.若容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ
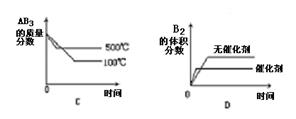
对于可逆反应:A2(g)+3B2(g) 2AB3(g) △H>0下列图象中正确的是
2AB3(g) △H>0下列图象中正确的是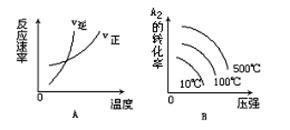
如图所示是298 K时N2与H2反应过程中 ,能量变化的曲线图.下列叙述正确的是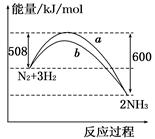
A.该反应的热化学方程式为: N2+3H2 2NH3 ΔH=-92 kJ/mol 2NH3 ΔH=-92 kJ/mol |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热改变 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
下列有关热化学方程式的叙述中,正确的是
| A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,该反应的热化学方程式是 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=+57.4 kJ·mol-1 |
| B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石一定比石墨稳定 |
| C.已知2H2O(g)=2H2(g)+O2(g) △H=+483.6 kJ·mol-1,则提供483.6 kJ热量时,一定会使2 mol H2O (g)发生分解 |
| D.已知C(s)+O2(g)=CO2(g) △H=a kJ·mol-1,2C(s)+O2(g)=2CO(g),△H=b kJ·mol-1,则2CO(g)+O2(g)=2CO2(g) △H=(2a﹣b) kJ·mol-1 |
下列关于电解精炼铜的叙述中不正确的是
| A.粗铜板为阳极 |
| B.粗铜所含Au、Ag、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥 |
| C.电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e-=Cu |
| D.精铜的纯度可达99.95%~99.98% |