反应N2O4(g) 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。正确的是
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。正确的是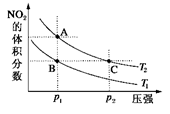
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C. A、C两点气体的平均相对分子质量:A>C
D.由状态B到状态A,可以用加热的方法
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系。下列有关物质的推断正确的是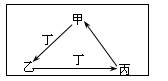
| A.若甲为焦炭,则丁可能是O2 |
| B.若甲为Fe,则丁可能是Cl2 |
| C.若甲为AlCl3,则丁可能是NH3 |
| D.若甲为NaHCO3,则丁可能是HCl |
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是 
| A.工业上通过电解熔融状态MgCl2制取金属镁 |
| B.用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C.在第②、④步骤中,溴元素均被氧化 |
| D.制取NaHCO3的反应是利用其溶解度小于NaCl |
下列物质的转化在指定条件下能实现的是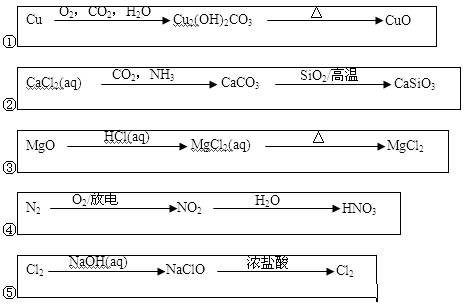
| A.①④⑤ | B.①②④ | C.②③⑤ | D.①②⑤ |
下列物质中,既含有极性键又含有非极性键的是:
| A.CH2=CH2 | B.CO2 | C.Na2O2 | D.NH4Cl |
下列各分子中所有原子都满足最外层为8电子结构的是
| A.BeCl2 | B.PCl3 | C.PCl5 | D.H2S |