某实验小组的同学在整理实验仪器时,发现了一个盛有黑色固体的烧杯。在请教老师后,同学们得知烧杯中的固体是加热制取氧气的剩余物(反应完全),从中可以回收得到MnO2。小组同学将黑色固体取出,并对其进行了探究。
【查阅资料】①实验室中可以加热二氧化锰和氯酸钾(KClO3)固体的混合物制取氧气。其反应的文字表达式为:氯酸钾 氯化钾+氧气。
氯化钾+氧气。
②氯化钾溶于水,其水溶液呈无色;锰酸钾溶于水,其水溶液呈绿色。
③催化剂在化学反应前后,其质量和化学性质保持不变。
探究活动一:探究黑色固体是哪个化学反应的剩余物。
【猜想】猜想一:过氧化氢制取氧气;
猜想二:氯酸钾制取氧气;
猜想三: 制取氧气。
请写出猜想一制取氧气反应的表达式 ,
根据所学知识和以上信息判断,猜想一不成立,理由是 。
【进行实验】取少量黑色固体于另一个烧杯中,加入足量蒸馏水溶解,振荡,过滤后得到黑色滤渣和无色滤液。
【得出结论】猜想 成立,理由是 。
探究活动二:探究二氧化锰在氯酸钾固体加热制取氧气反应中的作用。
【猜想】猜想一:是反应物;猜想二:是催化剂。
【进行实验】
| 实验操作 |
实验现象 |
| 1、取12.25g氯酸钾在试管中加热,把带火星的木条伸入试管。 |
固体融化,产生少量气体,木条上的火星变亮。 |
| 2、取12.25g氯酸钾和2.0g二氧化锰混合均匀后在试管中加热,把带火星的木条伸入试管。 |
___________________。 |
| 3、待反应完全后,将试管中的剩余物加足量的水溶解,过滤,并将全部滤渣洗涤、干燥、称量。 |
称量固体的质量是_______g |
【实验结论】猜想二成立,二氧化锰在反应中起到催化作用。
【反思与交流】小贝同学提出,前面的实验不足以证明二氧化锰在这个反应中起到了催化作用,因为没有证明二氧化锰的 在反应前后不变。
现有银、铜、铁三种金属,某研究小组的同学为探究银、铜、铁的金属活动性顺序,设计了三个实验:Ⅰ.将铁片浸入稀硫酸中;Ⅱ.将银片浸入稀硫酸中;Ⅲ.将铁片浸入硫酸铜溶液中。
(1)实验Ⅰ的现象是:有气泡产生,溶液由无色逐渐变为浅绿色。反应的化学方程式为:_____________________________________________________;
反应产生的气体可用________的方法检验。
(2)上述三个实验还不能完全证明三种金属的活动性顺序,请你补充一个实验来达到实验目的(写出实验操作和现象)____________________________。
根据以上研究,三种金属的活动性由强到弱的顺序是____________。
(3)将银、铜、铁中的两种金属分别放入________溶液中,即可验证这三种金属的活动性强弱。
(4)将铜片加热,铜片表面变黑。同学们设计如下实验证明此黑色物质是氧化铜。
| ①实验操作 |
②实验现象 |
| 剪下一片变黑的铜片,放入试管中,加入足量的______溶液 |
铜片表面的黑色物质全部消失,露出红色的铜,溶液变为________色 |
水和二氧化碳而变质。某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程。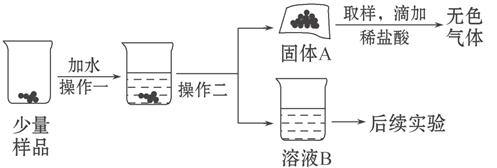
请你参与探究过程:
(1)为了使样品充分溶解,操作一还要用到的玻璃仪器是;操作二的名称是。
(2)固体A中一定含有。
(3)溶液B成分的探究:
【查阅资料】①Ca(OH)2、Na2CO3溶于水无明显的温度变化;
②Na2CO3溶液呈碱性,能使酚酞试液变红;
③CaCl2溶液呈中性。
【猜想】溶液B中的溶质可能为:①NaOH ②Na2CO3
③NaOH和Na2CO3④Ca(OH)2和(填化学式)。
【设计方案并进行实验】甲、乙同学分别设计如下方案并进行探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3。
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质一定含有NaOH。
【反思与评价】丙同学认真分析上述两位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断。他认为溶液B中的溶质一定含有Na2CO3,可能含有NaOH。为进一步确认溶液B中是否含NaOH,他做了如下实验。
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量溶液B于试管中,加入足量CaCl2溶液 ②过滤,在滤液中滴加酚酞试液 |
①有白色沉淀生成 ②溶液由无色变为红色 |
猜想③正确 |
实验步骤①中发生的化学反应方程式是,其实验目的是。
(4)实验过程中,同学们发现向样品中加水时还放出大量的热,综合以上探究,下列对样品成分分析正确的是(填序号)。
A.一定有NaOH
B.一定有Na2CO3
C.一定有CaO
D.至少有NaOH、CaO中的一种
某化学兴趣小组利用下列装置进行O2、CO2的实验室制法和有关性质的研究。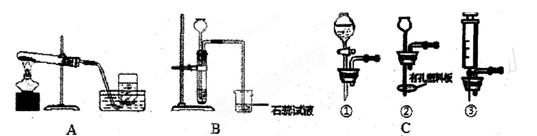
(1)甲同学要用KMnO4固体来制取O2,应选用上图中的装置(填编号),该反应的化学方程式是。从实验操作程序看,首先要,再装入药品进行实验。
(2)乙同学用浓盐酸和大理石在B装置中反应,制取CO2并检验其有关性质,观察到烧杯中紫色石蕊试液变红。对这一变化的合理解释是(填序号)
A.产生的CO2直接使石蕊试液变红
B.产生的CO2与水反应生成H2CO3使石蕊试液变红
C.挥发出的氯化氢溶于水使石蕊试液变红
(3)B装置中长颈漏斗虽可随时添加液体,但无法控制反应速率。可选择C组中(填序号)来取代B装置中的长颈漏斗,以达到控制反应速率的目的。
针对利用双氧水和二氧化锰制取氧气的实验,请结合如图1所示的常用的仪器和装置。回答有关问题: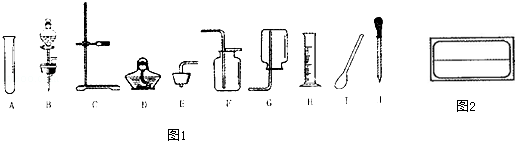
(1)配制溶液:若配制60g溶质质量分数为5%的双氧水溶液,需要30%的双氧水溶液g。在量取水的操作中,当水面接近所需刻度时,应改用(填仪器名称)加水至所需刻度。
(2)贴标签:将配制好的溶液装入试剂瓶中,请在如图2所示的标签内填入试剂瓶所贴标签的内容。
(3)根据反应原理选仪器:用双氧水和二氧化锰制取氧气,该反应的化学方程式是。其发生装置和收集装置可选择上图中的(填序号)组合。
(4)实验步骤:
①检查氧气发生装置的。
②装药品:先往容器中装入固体粉末,再装入液体试剂。
③收集气体,并用带火星的木条来验满。验满的方法是利用氧气具有的性质。
④回收处理二氧化锰:把氧气发生装置容器内的残留物经(写操作名称)洗涤、干燥回收二氧化锰。
化学兴趣小组对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
【设计并实验】用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 |
硫酸的质量分数(均取20mL) |
锌的形状(均取1g) |
氢气的体积(mL)(均收集3分钟) |
| ① |
20% |
锌粒 |
31.7 |
| ② |
20% |
锌片 |
50.9 |
| ③ |
20% |
锌粒 |
61.7 |
| ④ |
30% |
锌片 |
79.9 |
(1)写出稀硫酸与锌反应的化学方程式。
(2)用下图装置收集并测量氢气的体积,其中量筒的作用是,氢气应从(填e或f或g)管通入。
【收集证据】(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是。
【得出结论】(4)结论是。