由下列实验事实所得出的相应结论的因果关系正确的是
| |
实验事实 |
结论 |
| A |
KClO3和SO3溶于水后能导电 |
KClO3和SO3为电解质 |
| B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
| C |
将CO2通入NaAlO2溶液会产生白色沉淀 |
结合H+的能力:HCO3-<AlO2 |
| D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
由2—氯丙烷制取少量的1,2—丙二醇时,需要经过下列哪几步反应
| A.加成→消去→取代 | B.消去→加成→水解 |
| C.取代→消去→加成 | D.消去→加成→消去 |
某有机物的结构简式如图,该物质不应有的化学性质是
①可燃烧;②可跟溴加成;
③可使酸性KMnO4溶液褪色;④可跟NaHCO3溶液反应;
⑤可跟NaOH溶液反应;⑥可在碱性条件下水解
| A.①③ | B.③⑥ | C.④⑤ | D.⑥ |
下列说法错误的是
| A.同系物一定符合同一通式 |
| B.同分异构体一定具有相同的最简式 |
| C.一种元素形成的不同物质可能互为同分异构体 |
| D.同系物的化学性质相似,物理性质随着碳原子数增加而有规律的变化 |
已知可逆反应:N2(g)+3H2(g)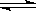 2NH3(g)△H=-92kJ·mol-1下列关于此反应的说法中错误的是
2NH3(g)△H=-92kJ·mol-1下列关于此反应的说法中错误的是
| A.加压可使该反应的反应速率变大 |
| B.该反应中反应物的总能量比生成物的总能量高 |
| C.将1molN2和3molH2混合进行反应,反应完成时放出的热量为92kJ |
| D.单位时间内生成1molN2,同时消耗3molH2说明该反应达到平衡状态 |
短周期主族元素A、B、C、D,原子序数依次增大。A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是( )
A.原子半径:A<B<C<D B.非金属性:C>A
C.最高价氧化物对应水化物的酸性:D>C D.单质B常温下能溶于浓硝酸