有X、Y、Z、R四种短周期主族元素,Y、Z、R同周期。相关信息如下:
| |
相关信息 |
| X |
单质为双原子分子。若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y |
含Y元素的物质焰色反应为黄色 |
| Z |
同周期元素中原子半径最小 |
| R |
R元素原子的最外层电子数是K层电子数的3倍 |
I.(1)Z元素在周期表的位置是 ,Y、Z、R简单离子的半径从大到小的顺序是 (用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。甲遇水可形成一种常见的漂白性物质。则甲的结构式为 ;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色。则Y2R2的电子式为 ,写出乙溶液在空气中变质生成Y2R2的化学方程式 。
II.元素X与氢可形成多种化合物,如丙、丁、戊。
(4)丙为一元弱酸,酸性与醋酸类似,对热十分稳定但受撞击就爆炸。8.6 g丙爆炸分解生成H2和6.72 L(标况下)X2。写出其爆炸的化学方程式 ;
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76 g·L-1,则物质丁的化学式为 ;
(6)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式 ,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法) 。
A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系。根据要求回答问题: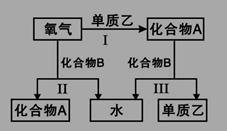
(1)上图三个反应中,属于氧化还原反应的有 个。
(2)若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有 。
A.还原性:H2R>H2O B.酸性:H2R>H2O
C.稳定性:H2R<H2O D.沸点:H2R<H2O
(3)若化合物B常温下为气体,其水溶液呈碱性(答题必须用具体物质表示)。
①化合物B的电子式为______;其水溶液呈碱性的原因是 (用离子方程式表示)。
反应III的化学方程式为______________________。
②化合物B可与O2组成燃料电池(氢氧化钾溶液为电解质溶液),其反应产物与反应Ⅲ相同。写出该电池负极的电极反应式______________________。
③当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为△H1和△H2,则反应Ⅰ的热化学方程式为______________(注:反应条件相同、所有物质均为气体)。
(10分)碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程。
(1)氟碳酸铈的化学式为为CeFCO3,该化合物中,Ce的化合价为 。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为 。
(3)试剂X是 。
(4)若试剂X改为氢氧化钠溶液,则反应生成难溶物—一氢氧化铈(Ⅲ),其暴露于空气中时变成紫色,最终变成黄色的氢氧化高铈(Ⅳ)。氢氧化铈在空气中被氧化成氢氧化高铈的化学方程式为 。
(5)取(4)中得到的Ce(OH)4产品(质量分数为97%)1.00 g,加硫酸溶解后,用0.1000mol·L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+),则需要滴加标准溶液的体积为 mL。
如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入0.6mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9g。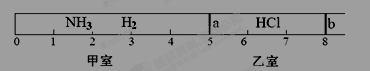
(1)甲室中气体的物质的量为 。
(2)甲室中气体的质量为 。
(3)甲室中NH3,H2的物质的量之比为 。
(4)将隔板a去掉,发生下列反应:HCl(g)+NH3(g)=NH4Cl(s),当HCl与NH3充分反应后,活塞b将位于刻度“ ”处(填数字)。
某一反应体系中涉及的反应物和生成物共有4种物质:X、Cl2、NH3、N2。当转移的电子总数为a个时,氮气数量变化了bmol。
(1)阿伏伽德罗常数为 (用含啊a、b的代数式表示)
(2)X可能有两种组成:HCl、NH4Cl,为确定X的化学式,某同学分别取同温同压下体积分别为V1、V2的两种物质(氧化剂与还原剂)充入一恒压、容积可变的密闭容器中,在一定条件下反应完全并恢复到原温后,再测出容器的容积V3。
①若实验结果是________ (用V1、V2与V3间关系来表示,后同) ,则X的化学式一定为HCl。
②若实验结果是_________,则X的化学式为NH4Cl
(共10分)A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大。A是宇宙中含量最高的元素,B可形成多种同素异形体,其中一种的硬度自然界中最大。D元素原子的最外层电子数是次外层电子数的3倍。E元素的最高价氧化物的水化物的酸性强于硫酸。
(1)写出元素C在元素周期表的位置 ,单质E的工业制备的离子方程式为________。
(2)B、C、D三种元素的最简单氢化物的稳定性从大到小的顺序是 (填化学式),
B的单质在加热条件下能与C的最高价氧化物对应的水化物的浓溶液反应,写出对应的化学方程式 。
(3)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒中离子之间反应的一个离子方程式: 。