某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
| A.混合酸液中NO3-的物质的量为0.4mol |
| B.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气 |
| C.溶液中最终溶质为FeSO4 |
| D.c(H2SO4)为5 mol·L-1 |
C、N、S都是重要的非金属元素,下列说法正确的是
A.三者对应的氧化物均为酸性氧化物
B.实验室可用NaOH溶液处理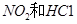 废气
废气
C.三者的单质直接与氧气反应都能生成两种氧化物
D.CO2、NO2、SO2都能与H2O反应,其反应原理相同
下列反应的离子方程式正确的是
A. |
B.用FeC13溶液腐蚀电路板: |
C.向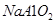 溶液中通入过量 溶液中通入过量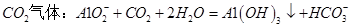 |
D.用食醋除去水瓶中的水垢: |
关于元素及其化合物,下列说法正确的是
| A.C12具有氧化性,故可以做漂白剂 |
| B.Na、A1、Fe三种单质在一定条件下与水反应都生成H2和对应的碱 |
| C.将浓硝酸、浓硫酸露置在空气中,两溶液的质量均增大、浓度均减小 |
D.将表面有铜绿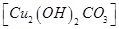 的铜器放入盐酸中浸泡,可除去铜绿 的铜器放入盐酸中浸泡,可除去铜绿 |
汽车剧烈碰撞时,安全气囊中发生反应: 。则下列判断错误的是.
。则下列判断错误的是.
| A.该反应能在瞬间完成,并产生大量气体 |
| B.生成标准状况下2.24L气体,该反应转移电子的物质的量为0.5mol |
| C.该反应中的氧化剂为KNO3 |
| D.被氧化和被还原的N原子的物质的量之比为15:1 |
下列叙述正确的是
| A.液溴易挥发,在存放液溴的试剂瓶中应加水封 |
| B.不慎将硫酸沾在皮肤上,立刻用干布擦净,然后用氢氧化钠溶液冲洗 |
| C.实验室配制一定物质的量浓度的溶液,定容时仰视刻度线,所配制溶液浓度偏大 |
| D.某溶液中加入BaC12溶液,产生了不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+ |