下列根据反应原理设计的应用,不正确的是
A.CO32—+H2O HCO3—+OH-;用热的纯碱溶液清洗油污 HCO3—+OH-;用热的纯碱溶液清洗油污 |
B.Al3++3H2O Al(OH)3(胶体)+3H+;明矾净水 Al(OH)3(胶体)+3H+;明矾净水 |
C.TiCl4+(x+2)H2O(过量) TiO2·xH2O↓+4HCl;制备TiO2纳米粉 TiO2·xH2O↓+4HCl;制备TiO2纳米粉 |
D.SiCl2+H2O Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入NaOH Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入NaOH |
在碱性溶液中能大量共存且溶液为无色透明的离子组是()
| A.K+、MnO4-、Na+、Cl- | B.K+、Na+、NO3-、CO32- |
| C.Na+、H+、NO3-、SO42- | D.Fe3+、Na+、Cl-、SO42- |
某元素原子最外层电子层上只有一个电子,该元素
| A.一定是金属元素 | B.可能是金属元素,也可能不是金属元素 |
| C.一定是ⅠA族元素 | D.一定是非主族元素 |
对发现元素周期律贡献最大的化学家是
| A.牛顿 | B.道尔顿 |
| C.阿佛加德罗 | D.门捷列夫 |
下面有关离子晶体的叙述中,不正确的是()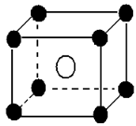
| A.1mol氯化钠中有NA个NaCl分子 |
| B.氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 |
| C.氯化铯晶体中,每个CS+周围紧邻8个Cl- |
| D.平均每个NaCl晶胞中有4个Na+、4个Cl- |
下列各组物质中,化学键类型相同,晶体类型也相同的是:
| A.C(金刚石)和CO2 | B.NaBr和HBr |
| C. Cl2和KCl. | D.CH4和H2O |