已知下列三个数据:7.1×10-4 mol·L-1、6.8×10-4 mol·L-1、6.2×10-10 mol·L-1分别是三种酸的电离平衡常数。若这三种酸可发生如下反应:
①NaCN+HNO2=HCN+NaNO2 ②NaCN+HF=HCN+NaF ③ NaNO2+HF=HNO2+NaF
则下列叙述中不正确的是
| A.HF的电离平衡常数为7.1×10-4 mol·L-1 |
| B.HNO2的电离平衡常数为6.2×10-10 mol·L-1 |
| C.根据①③两个反应即可知三种酸的相对强弱 |
| D.HNO2的电离平衡常数比HCN的大,比HF的小 |
对常温下0.1mo1/L的醋酸溶液,以下说法正确的是
| A.由水电离出来的c(H+)=1.0×10—13mo1/L |
| B.c(CH3COOH)>c(H+)>c(CH3COO—)>c(OH—) |
| C.与同浓度的盐酸分别加水稀释10倍:pH(醋酸)>pH(盐酸) |
| D.与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)=0.1mo1/L |
下列各项叙述I、Ⅱ都正确且二者的原理最相似的是
| 叙述I |
叙述Ⅱ |
|
| A |
FeS难溶于水,却溶于稀硝酸 |
CaCO3难溶于稀硫酸,却溶于醋酸 |
| B |
浓硝酸要密封保存阴凉处 |
漂白粉要密封保存在阴凉处 |
| C |
盐酸与铁反应生成氯化亚铁 |
少量氯气与铁反应生成氯化亚铁 |
| D |
碳酸钠溶液显弱碱性 |
氯化铵溶液显弱酸性 |
已知N2(g)+3H2(g) 2NH3(g)△H=— 92.4kJ•mo1—1,下列结论正确的是
2NH3(g)△H=— 92.4kJ•mo1—1,下列结论正确的是
| A.在密闭容器中加入1mol N2和3mol H2充分反应放热92.4kJ |
B.N2(g)+3H2(g) 2NH3(l)△H=— QkJ•mo1—1,则Q>92.4 2NH3(l)△H=— QkJ•mo1—1,则Q>92.4 |
| C.增大压强,平衡向右移动,平衡常数增大 |
| D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率一定为60% |
下列叙述正确的是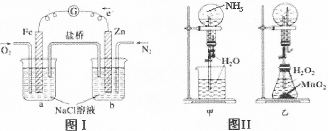
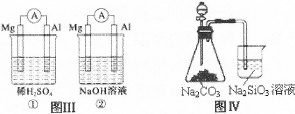
| A.图I装置中通入N2和O2的作用是相同的 |
| B.图Ⅱ中甲、乙两装置产生喷泉的原理一样 |
| C.图Ⅲ①装置中镁片是原电池的负极;②装置中镁片是原电池的正极 |
| D.图Ⅳ分液漏斗盛硝酸能证明非金属性N>C>Si,盛硫酸能证明非金属性S>C>Si |
水溶液中能大量共存的一组离子是
| A.Al3+、Cl—、A1O2—、SiO32— |
| B.H+、Na+、S2—、ClO— |
| C.K+、Mg2+、SO42—、MnO4ˉ |
| D.Fe3+、Ca2+、SCN—、NO3— |